植物トータル RNA 分離キットと多糖類とポリフェノールが豊富な植物用トータル RNA 精製キット
仕様
50 回の準備、200 回の準備
このキットは、Foregene が開発したスピンカラムとフォーミュラを使用しており、多糖類やポリフェノールを多く含むさまざまな植物組織から高純度・高品質のトータル RNA を効率よく抽出できます。上清および組織ライセートからゲノム DNA を簡単に除去できる DNA クリーニング カラムを提供します。RNA 専用カラムは RNA を効果的に結合できます。このキットは、同時に多数のサンプルを処理できます。
システム全体にRNaseが含まれていないため、精製されたRNAは分解されません。バッファー PRW1 およびバッファー PRW2 は、得られた RNA がタンパク質、DNA、イオン、および有機化合物によって汚染されていないことを保証します。
キットのコンポーネント
| バッファPSL1、バッファPS、バッファPSL2 |
| バッファPRW1、バッファPRW2 |
| RNase フリー ddH2O、DNA クリーニング カラム |
| RNA のみのカラム |
特徴と利点
■ 氷浴や低温遠心分離を行わず、プロセス全体を通して室温 (15 ~ 25℃) で操作します。
■ コンプリートキット RNase-Free のため、RNA 分解を心配する必要はありません。
■ 多糖類およびポリフェノールの植物サンプルからの RNA の精製に特に適しています。
■ DNA クリーニングカラムは DNA に特異的に結合するため、キットは DNase を添加せずにゲノム DNA 汚染を除去できます。
■ 高い RNA 収量: RNA 専用カラムと独自のフォーミュラにより、効率的に RNA を精製できます。
■ スピードが速い:操作が簡単で30分以内に完了します。
■ 安全性: 有機試薬は必要ありません。
■ 高品質: 精製された RNA フラグメントは高純度で、タンパク質やその他の不純物が含まれていないため、さまざまな下流実験アプリケーションに対応できます。
製品パラメータ
■ 下流アプリケーション: ファーストストランド cDNA 合成、RT-PCR、分子クローニング、ノーザン ブロットなど。
■ サンプル:多糖類およびポリフェノールの生または冷凍植物組織
■投与量:植物組織 50mg
■精製カラムの最大RNA結合容量:80μg
■溶出量:50~200μl
キットの適用
多糖類とポリフェノールの含有量が高い、新鮮または冷凍の植物組織サンプル (特に新鮮な植物の葉組織) からのトータル RNA の抽出および精製に適しています。
作業の流れ
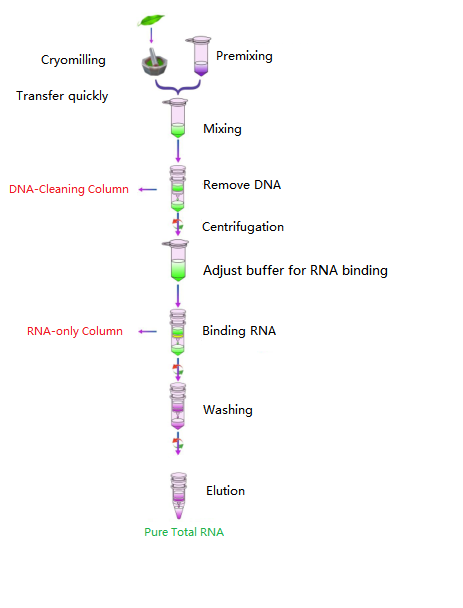
ダイアグラム
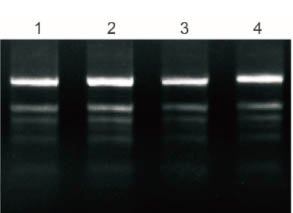
Plant Total RNA Isolation Kit Plus は、50 mg の新鮮な葉の多糖類とポリフェノールを処理し、5% 精製 RNA を電気泳動でテストしました。
1:バナナ
2:イチョウ
3: コットン
4: ザクロ
保管と賞味期限
このキットは、室温 (15 ~ 25℃) の乾燥状態で 24 か月間保存できます。長期間保存する必要がある場合は、2〜8℃で保存できます。
Buffer PSL1 は、β-メルカプトエタノールを添加後、4℃で 1 か月間保存できます (実験と同時に添加することをお勧めします)。
柱が詰まっている
カラムに栓をすると、RNA 収量が減少するか、RNA の精製が不可能になり、得られる RNA の量が少なくなります。
一般的な原因分析:
1. サンプルブレイクが徹底されていない。
サンプルの破損によって DNA-CLEANING COLUMN が完全にブロックされるわけではありませんが、RNA の収量と品質には影響します。サンプルを破砕する際には、十分な液体窒素中で急速な粉砕操作を行うことをお勧めします。サンプルの細胞壁、細胞膜、その他の組織を破砕するようにしてください。ポリオール多糖類の植物サンプルには、Plant Total RNA ISOLATION KIT PLUS の使用をお勧めします。
2. DNA-Cleaning Column で分離したサンプル上清を吸引する際、細胞断片化した沈殿物を吸入する可能性があります。
細胞断片化した沈殿物が採取されると、RNA 吸着操作を実行するときに RNA-ONLY カラムがブロックされます (ステップ 6 を参照)。この上清を吸引する際は、細胞破片が吸引されないよう注意して行うことをお勧めします。
3. サンプルの初期量が多すぎる。
サンプルを過剰に使用すると、バッファー PSL1 によるサンプルの断片化または細胞溶解が不完全になり、精製中に精製カラムが閉塞してしまいます。Plant Total RNA Isolation Kit 単一の精製操作サンプルはそれぞれ 50 mg です。ポリオール多糖類の植物サンプルについては、Plant Total RNA ISOLATION KIT PLUS をお試しいただくことをお勧めします。
4. 遠心分離機の温度が低すぎます。
RNA の単離および精製プロセス全体は室温 (20 ~ 25 ℃) で実行されます。°C) ただし、サンプル組織が液体窒素によって破壊される場合を除きます。一部の極低温遠心分離機の温度は 20 ℃未満です。℃、DNA-Cleaning Column および/または RNA-Only Column の詰まりを引き起こす可能性があります。このような場合は、遠心機の温度を 20 ~ 25 に設定してください。℃、 と溶解混合物および/またはエタノールを添加した上清が 37 ℃に予熱されていることを確認してください。°C.
RNA が抽出されないか、RNA 収量が低い
通常、回収効率に影響を与える要因は数多くあります。たとえば、サンプル RNA の含有量、操作方法、溶出量などです。
一般的な原因を以下のように分析します。
1.操作中に氷浴または低温(4℃)遠心分離を行った。
推奨: 室温 (15 ~ 25 ℃) で動作させてください。°C) 全プロセスにおいて、氷浴や低温遠心分離は行わないでください。
2.サンプルの不適切な保存や長期保存によりRNAが劣化した場合。
推奨事項: 採取したばかりのサンプルは液体窒素で急速凍結し、-80°C で長期間保存する必要があります。サンプルの凍結と解凍を繰り返すことは避けてください。または、サンプルをすぐに RNA 安定化剤 RNAlater 溶液 (動物サンプル) に浸します。
3.サンプルの断片化と溶解が不十分であると、精製カラムの閉塞につながります。
提案: 組織を粉砕するときは、組織が十分に粉砕されていることを確認し、事前に調製したバッファー PSL1 にすばやく移してください (正しい割合の β-ME が添加されていることを確認してください。手順のステップ 1 を参照してください)。
4.溶離液の添加が間違っています。
提案: RNase-Free ddH2O が精製カラムメンブレンの中央に滴下されていることを確認してください。
5.正しい量の無水エタノールがバッファー PSL2 またはバッファー PRW2 に添加されませんでした。
提案: キットを使用する前に、指示に従い、適切な量の無水エタノールをバッファー PSL2 およびバッファー PRW2 に加え、よく混合してください。
6.組織サンプルの量が不適切です。
提案: 500 μl のバッファー PSL1 あたり 50 mg の組織を使用します。組織の使用量が多すぎると、抽出される RNA の量が減少し、得られる RNA の純度も低下します。初回サンプル投与量は RNA 抽出操作あたり 50 mg を超えないようにすることを強くお勧めします。
7.溶出量が不適切、または溶出が不完全。
提案: 精製カラムの溶離液量は 50 ~ 200 μl です。溶出効果が満足できない場合は、予熱した RNase-Free ddH2O を加えた後、室温での時間を 5 ~ 10 分間延長することをお勧めします。
8.精製カラムには、BufferPRW2 で洗浄した後にエタノールが残留します。
提案: 空のチューブを 1 分間遠心分離し、バッファー PRW2 で洗浄した後にまだエタノールが残っている場合は、空のチューブの遠心時間を 2 分間に増やすか、精製カラムを室温に 5 分間置いて残留エタノールを完全に除去します。
9.キットの使用方法が間違っていた。
提案: ポリフェノール多糖類の植物サンプルの場合、Plant Total RNA Isolation Kit などの一般的なキットを使用すると、理想的な RNA サンプルを取得できない可能性があります。ポリフェノール多糖類植物サンプル用に特別に設計された Plant Total RNA IsolationKit Plus の使用をお勧めします。ポリフェノールおよび多糖類の植物サンプルから RNA を抽出するために特別に開発されたキットです。
OD260/OD280の値が低い
ddH2O で RNA を溶出し、分光光度計の読み取りに使用すると、OD260/OD280 値が低くなります。比較的正確な OD260/OD280 値を取得するには、(RNA の溶出には RNase-Free ddH2O ではなく) 10 mM Tris-HCl、pH 7.5 を使用することをお勧めします。19 ページの「RNA 濃度および精製アッセイ」を参照してください。
精製されたRNAは分解される
精製された RNA の品質は、サンプルの保存、RNase の汚染、操作などの要因に関連します。
一般的な原因の分析:
1.組織サンプルが採取後に期限内に保管されなかった。
推奨: 組織サンプルを採取後、期限内に使用しない場合は、直ちに液体窒素中で低温で保存するか、液体窒素で急速凍結した後、長期保存する場合は -80°C に移すか、サンプルをすぐに RNA 安定化剤 RNAlater 溶液 (動物サンプル) に浸してください。RNA 抽出には、新しく採取した組織サンプルを使用するようにしてください。
2.組織サンプルの凍結と融解の繰り返し。
提案: 組織サンプルを保存する場合、サンプルの凍結と融解の繰り返しによる RNA の劣化を避けるために、組織サンプルを保存用に小さく切り、使用するときに一部を取り出すのが最善です。
3.手術室にRNaseが導入されているか、使い捨ての手袋やマスクなどを着用していない。
提案: RNA 抽出実験は RNA 操作を別々に行うのが最善であり、RNase の導入による RNA の分解を最大限に避けるために、実験台は実験前に清掃し、実験中は使い捨ての手袋とマスクを着用する必要があります。
4.試薬は使用中にRNaseにより汚染されます。
提案: 関連実験用の新しいシリーズの植物トータル RNA 抽出キットと交換してください。
5.RNA操作に使用する遠心管やピペットチップはRNaseで汚染されています。
提案: RNA 抽出に使用する遠心管、ピペットチップ、ピペットなどがすべて RNase フリーであることを確認してください。
取扱説明書:
Plant Total RNA Isolation Kit Plus 取扱説明書