セントラルドグマでは、RNA が DNA とタンパク質発現の間の転写メディエーターであることはよく知られています。DNA の検出と比較して、RNA の検出は生物体内の遺伝子発現をより客観的に反映できます。RNAを用いた実験には、qRT-PCR、RNA-Seq、融合遺伝子検出などが含まれます。RNA自体の特性(RNAの糖環はDNAの糖環よりも遊離水酸基を1つ多く持つ)と、環境中に多数のRNaseが存在することにより、RNAはDNAに比べて不安定で分解しやすい性質があります。ゴミが入ったり出たり、RNA の品質が良くない場合、実験結果は満足のいくものではないに違いなく、特に不正確なデータや再現性の低さとして現れます。したがって、RNA の処理にはより注意を払う必要があり、その後の実験データの精度と精度を確保するためには品質管理のリンクもより重要になります。
RNA の品質管理には、一般的に次のような方法が一般的に使用されます。
- 分光測光法
- アガロースゲル電気泳動
- アジレントバイオアナライザー
- リアルタイム蛍光定量PCR
- 量子ビット蛍光色素法
01 分光測光法
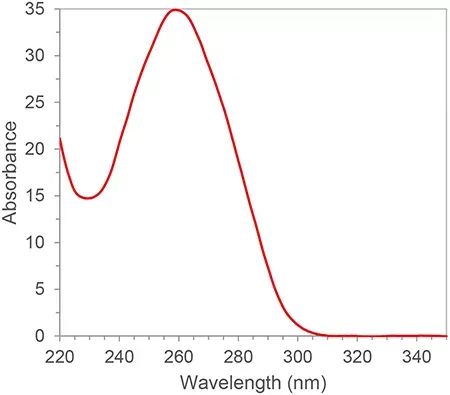
RNA は共役二重結合を持ち、波長 260nm に吸収ピークがあります。ランバート・ビールの法則に従って、260nm の吸収ピークから RNA 濃度を計算できます。さらに、260nm、280nm、230nmの吸収ピークの比率からRNAの純度を計算することもできます。280nm と 230nm は、それぞれタンパク質と小分子の吸収ピークです。適格な RNA 純度の A260/A280 および A260/A230 の比は 2 より大きい必要があります。2 未満の場合は、RNA サンプルにタンパク質または小分子の汚染があることを意味し、再度精製する必要があります。汚染源は、PCR 反応の増幅効率を阻害するなど、下流の実験に影響を及ぼし、不正確な定量結果をもたらします。RNA の純度はその後の結果に大きな影響を与えるため、分光測光法は一般に核酸実験の最初のステップで不可欠な品質管理リンクです。
図 1. 典型的な RNA/DNA 吸収スペクトル
02 アガロースゲル電気泳動
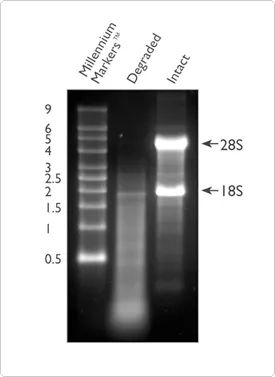
純度に加えて、RNA の完全性も RNA の品質を判断するための重要な指標の 1 つです。RNA の分解によりサンプル中に多数の短いフラグメントが生成されるため、効率的に検出でき、参照配列でカバーできる RNA フラグメントの数が減少します。RNA の完全性は、1% アガロースゲルでの全 RNA の電気泳動によってチェックできます。この方法では、ゲルを自分で構成することも、完全性テストに既製の E-Gel™ システムを使用することもできます。全 RNA の 80% 以上がリボソーム RNA であり、その大部分は 28S および 18S rRNA で構成されています (哺乳類系の場合)。良質の RNA は、5 Kb と 2 Kb に 2 つの明らかな明るいバー (それぞれ 28S と 18S の明るいバー) を示し、その比率は 2:1 に近い傾向があります。拡散状態にある場合は、RNA サンプルが分解されている可能性があることを意味するため、後述する方法を使用して RNA の品質をさらにテストすることをお勧めします。
図 2. アガロースゲル電気泳動における分解された RNA (レーン 2) と無傷の RNA (レーン 3) の比較
03 アジレントバイオアナライザー
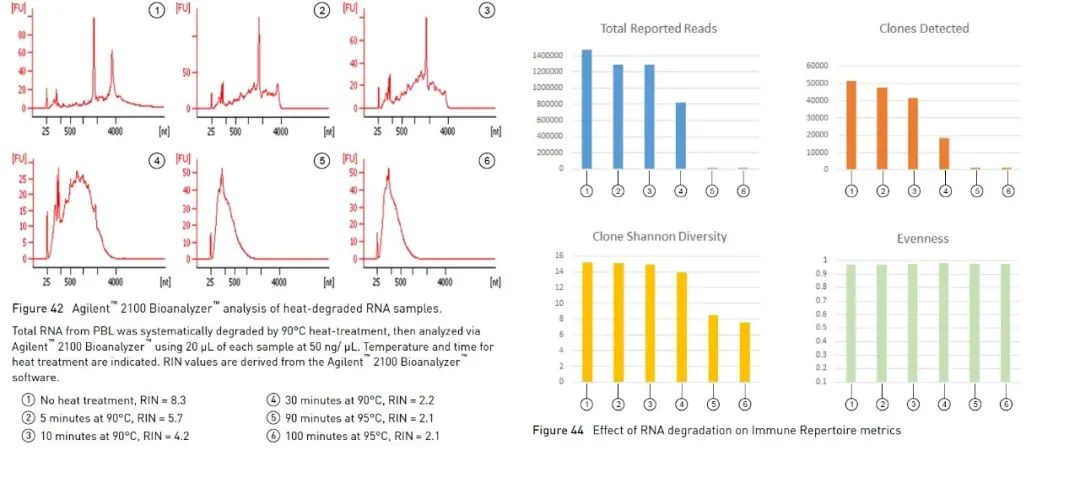
RNA の完全性を簡単かつ迅速に特定するのに役立つ上記のアガロース ゲル電気泳動法に加えて、Agilent バイオアナライザーを使用して RNA の完全性を決定することもできます。マイクロ流体工学、キャピラリー電気泳動、蛍光を組み合わせて RNA の濃度と完全性を評価します。内蔵アルゴリズムを使用して RNA サンプルのプロファイルを分析することにより、Agilent バイオアナライザーは参照 RNA 完全性値である RNA Integrity Number (以下、RIN) を計算できます [1]。RIN の値が大きいほど、RNA の完全性が高くなります (1 は非常に分解されており、10 は最も完全です)。RNA を含む一部の実験では、品質評価のパラメーターとして RIN を使用することが提案されています。ハイスループットシーケンシング実験(以下、NGS)を例にとると、Thermo Fisher の Oncomine パネル シリーズで B 細胞および T 細胞抗原受容体の検出に使用される Oncomine™ Human Immune Repertoire のガイドラインでは、RIN 値が 4 を超えるサンプルでより効果的なリードとクローンを測定できることが示唆されています(図 3)。パネルごとに異なる推奨範囲があり、多くの場合、RIN が高いほど、より効果的なデータが得られます。
図 3、Oncomine™ Human Immune Repertoire 実験では、RIN が 4 を超えるサンプルはより効果的なリードと T 細胞クローンを検出できます。【2】
ただし、RIN 値にもいくつかの制限があります。RIN は NGS 実験データの品質と高い相関関係がありますが、FFPE サンプルには適していません。FFPE サンプルは長期間にわたって化学処理されており、抽出された RNA の RIN 値は一般に比較的低くなります。ただし、これは、実験の有効データが不十分でなければならないという意味ではありません。FFPE サンプルの品質を正確に評価するには、RIN 以外の測定を使用する必要があります。Agilent バイオアナライザーでは、RIN に加えて、RNA の品質の評価パラメータとして DV200 値も計算できます。DV200 は、RNA サンプル中の 200 bp を超えるフラグメントの割合を計算するパラメーターです。DV200 は、RIN よりも FFPE サンプルの品質を示す優れた指標です。FFPE で抽出された RNA の場合、効果的に検出できる遺伝子の数および遺伝子の多様性と非常に高い相関関係があります [3]。DV200 は FFPE の品質検出の欠陥を補うことができますが、Agilent バイオアナライザは、サンプル中に阻害剤が含まれているかどうかを含め、RNA サンプルの品質問題を包括的に分析することはできません。阻害剤自体は、下流の実験の増幅効率に影響を与え、有用なデータの量を減少させる可能性があります。サンプル中に阻害剤が存在するかどうかを知るには、次に説明するリアルタイム蛍光定量 PCR 法を採用できます。
04 リアルタイム蛍光定量PCR
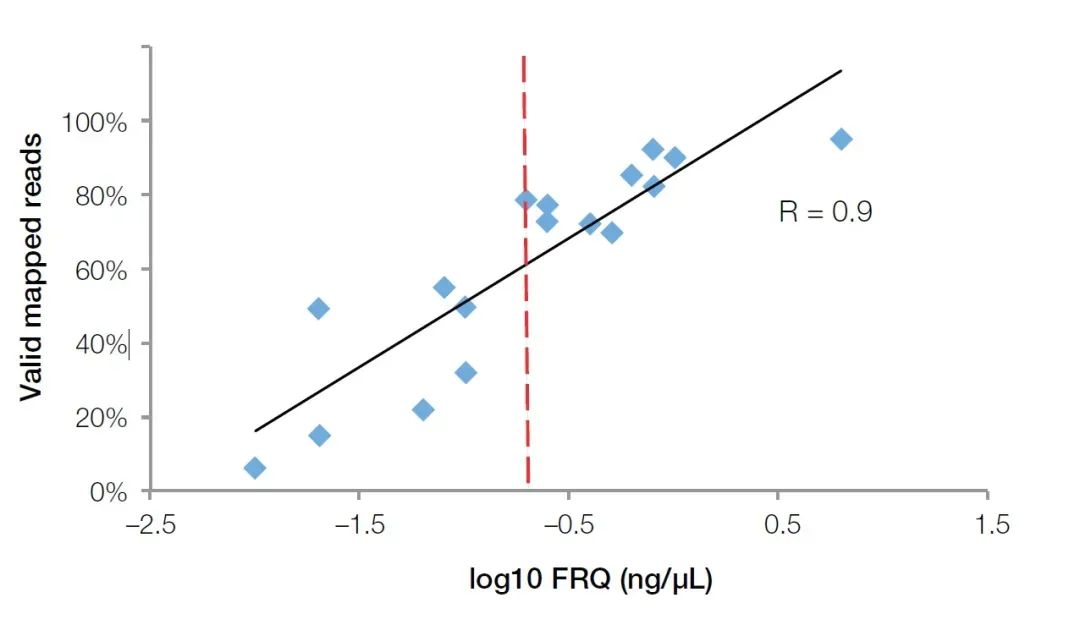
リアルタイム蛍光定量 PCR 法は、サンプル中の阻害剤を検出できるだけでなく、FFPE サンプル中の RNA の品質を正確に反映することもできます。Agilent の生物学的分析装置と比較して、リアルタイム蛍光定量装置は、その幅広い用途のため、主要な生物学研究所でより人気があります。RNA サンプルの品質をテストするには、GUSB (カタログ番号 Hs00939627) などの内部参照遺伝子用のプライマー プローブを購入または準備するだけです。このプライマー、プローブ、スタンダード(濃度既知の全RNA)のセットを使用して絶対定量実験を行うことにより、RNAの品質の評価基準として有効なRNA断片濃度を算出することができます(Functional RNA Quantitation(略称FRQ))。NGS テストでは、RNA サンプルの FRQ が有効データ量と非常に高い相関関係があることがわかりました。FRQ が 0.2ng/uL を超えるすべてのサンプルでは、リードの少なくとも 70% が参照配列を効果的にカバーできます (図 4)。
図 4、蛍光定量法によって検出された FRQ 値は、NGS 実験で得られた有効データと非常に高い相関関係 (R2>0.9) を示します。赤い線は 0.2 ng/uL に等しい FRQ 値です (log10 = -0.7)。【4】
リアルタイム定量 PCR 法は、FFPE サンプルに適用できるだけでなく、サンプル中の阻害剤を効果的に監視することもできます。内部陽性コントロール (IPC) とそのアッセイを使用して、検出対象のサンプルを反応系に追加し、蛍光定量を実行して Ct 値を取得します。Ct 値がサンプルなしの反応の Ct 値よりも遅れている場合、それはサンプル中に阻害剤が存在し、反応における増幅効率を阻害していることを示します。
05 量子ビット蛍光色素法
Qubit Fluorometer は、核酸の濃度と純度の検出に最も一般的に使用されている小型デバイスで、操作が簡単で、ほぼすべての分子生物学研究室に存在します。核酸に結合した蛍光色素(Qubit検出試薬)を検出し、核酸濃度を正確に計算します。Qubit は感度と特異性が高く、RNA を pg/µL 濃度まで正確に定量できます。Thermo Fisher の最新の新しいモデルである Qubit 4.0 は、核酸濃度を正確に定量するよく知られた機能に加えて、RNA の完全性も検出できます。Qubit 4.0 の RNA 検出システム (RNA IQ アッセイ) は、2 つの特定の蛍光色素を同時に検出することで RNA の完全性を検出します。これら 2 つの蛍光色素は、それぞれ RNA の大きなフラグメントと小さなフラグメントに結合できます。これら 2 つの蛍光色素はサンプル中の RNA の大きな断片の割合を示し、そこから RNA の品質を表す IQ (Integrity and Quality) 値を計算できます。IQ 値は FFPE サンプルと非 FFPE サンプルの両方に適用でき、その後のシーケンスの品質に大きな影響を与えます。NGS 実験を例にとると、Ion torrent™ プラットフォームで実行された RNA-Seq テスト実験では、IQ 値が 4 を超えるほとんどのサンプルで少なくとも 50% の有効読み取りが得られました (図 5)。上記の検出方法と比較して、Qubit IQ Assay は操作が便利で所要時間が短い (5 分以内) だけでなく、測定されたパラメーター IQ 値と下流の実験のデータ品質の間に大きな相関関係があります。
図 5、Qubit RNA IQ 値と RNA-Seq のマッピングされたリードの間には大きな相関関係があります。【5】
上記の紹介により、誰もがさまざまな RNA 品質管理方法について十分に理解できたと思います。実際に選択できるのは、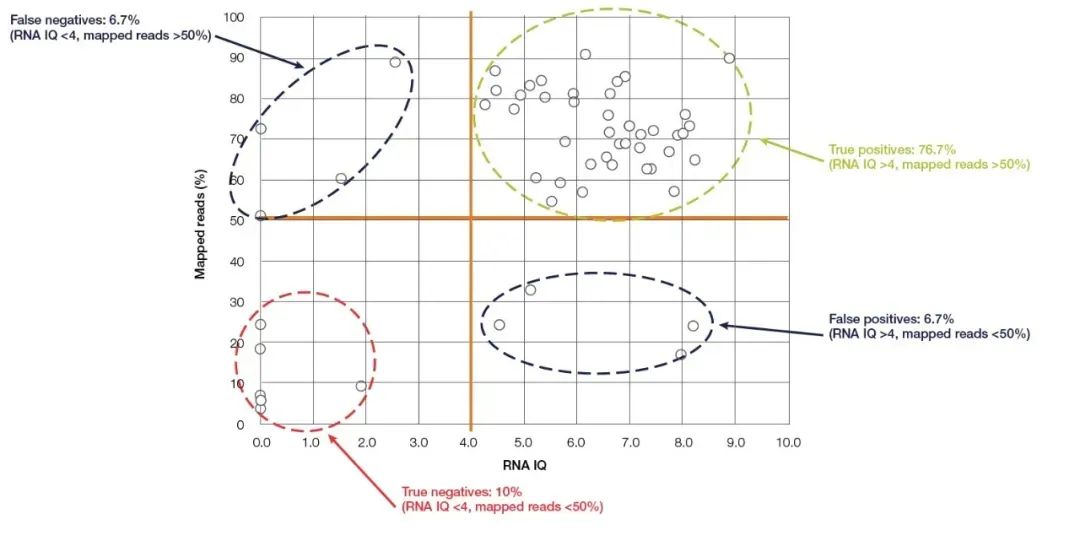 サンプルの種類と既存の機器に応じて、対応する方法を選択します。RNA の品質を適切に管理することによってのみ、サンプル品質の低下によるその後の実験の失敗を回避でき、貴重な時間、エネルギー、コストを節約できます。
サンプルの種類と既存の機器に応じて、対応する方法を選択します。RNA の品質を適切に管理することによってのみ、サンプル品質の低下によるその後の実験の失敗を回避でき、貴重な時間、エネルギー、コストを節約できます。
参考製品:
参考文献
【1】Schroeder, A.、Mueller, O.、Stocker, S. 他RIN: RNA 測定値に完全性値を割り当てるための RNA 完全性番号。BMC Molecular Biol 7、3 (2006)。https:// ドイ .org/10.1186/1471-21 99-7-3
【2】Oncomine Human Immune Repertoire ユーザーガイド (Pub. No. MAN0017438 Rev. C.0)。
【3】Leah C Wehmas、Charles E Wood、Brian N Chorley、Carole L Yauk、Gail M Nelson、Susan D Hester、Enhanced Quality Metrics for Assessing RNA Derived From Archival Formalin-Fixed Paraffin-Embedded Tissue Samples、Toxicological Sciences、第 170 巻、第 2 号、2019 年 8 月、357 ~ 373 ページ、https://doi.org/10.1093/toxsci/
投稿日時: 2023 年 6 月 12 日