qPCR 実験では、プライマーの設計も非常に重要です。プライマーが適切かどうかは、増幅効率が基準に達しているか、増幅産物が特異的であるか、実験結果が得られるかなどと密接に関係しています。
では、qPCR プライマーの特異性を高めるにはどうすればよいでしょうか?増幅効率が高い?
今日は、皆さんと一緒に qPCR プライマーを設計し、qPCR プライマーの設計を実験における効率的な知識スキルにしてみましょう。
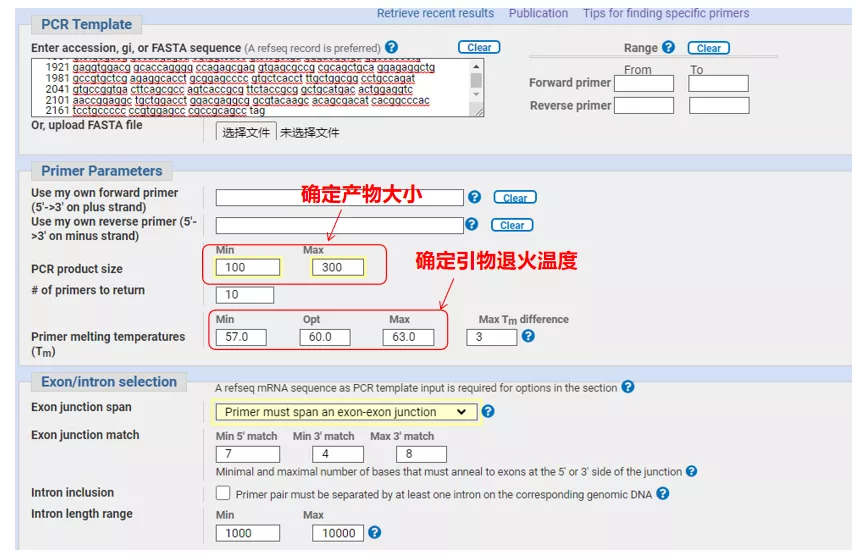
qPCR プライマーを設計するときは、通常、次の点に注意してください。プライマーはできる限りイントロンをまたいで設計する必要があり、産物の長さは 100 ~ 300 bp である必要があり、Tm 値はできる限り 60℃に近づける必要があり、上流と下流のプライマーはできる限り近くにある必要があり、プライマーの末端は G または C などにする必要があります。
1. イントロンをまたぐプライマーの設計
qPCR プライマーを設計する場合、イントロンをまたいで設計されたプライマーを選択すると、gDNA テンプレートの増幅を防ぐことができ、生成物はすべて cDNA の増幅に由来するため、gDNA コンタミネーションの影響を排除できます。
2. プライマーの長さ
プライマーの長さは一般に 18 ~ 30 nt であり、増幅産物の長さは可能な限り 100 ~ 300 bp の間に制御する必要があります。
プライマーが短すぎると非特異的な増幅を起こし、長すぎると二次構造(ヘアピン構造など)を形成しやすくなります。増幅産物が長すぎるとポリメラーゼの反応に適さず、PCR 増幅の効率に影響を与えます。
3. GC含有量とTm値
プライマーの GC 含有量は 40% ~ 60% の間に制御する必要があります。それが高すぎたり低すぎたりすると、反応の開始には役立ちません。同じ Tm 値とアニーリング温度を得るには、フォワード プライマーとリバース プライマーの GC 含有量が同じに近い必要があります。
Tm 値はできる限り 55 ~ 65℃、一般的には約 60℃ であるべきであり、上流と下流の Tm 値はできる限り近く、好ましくは 4℃以下であるべきです。
4. プライマーの 3' 末端で A を選択しないようにします。
プライマーの 3' 末端がミスマッチであると、塩基の違いにより合成効率に大きな差が生じます。最後の塩基が A の場合、ミスマッチの場合でも連鎖合成を開始できますが、最後の塩基が T の場合、ミスマッチ誘導の効率が大幅に低下します。したがって、プライマーの 3' 末端で A を選択することは避け、T を選択することをお勧めします。
プローブプライマーの場合、プローブの 5' 末端を G にすることはできません。単一の G 塩基が FAM 蛍光レポーターグループに接続されている場合でも、G は FAM グループによって放出される蛍光シグナルを消光する可能性があるため、偽陰性の結果が得られます。現れる。
5. ベース分布
プライマー内の 4 つの塩基の分布はランダムであることが好ましく、3' 末端に 3 つを超える連続する G または C、および 3 つを超える連続する G または C を避けます。G または C は、GC リッチな配列領域でペアリングを生成しやすいです。
6. プライマー設計領域は複雑な二次構造を避ける必要があります。
増幅産物の一本鎖が形成する二次構造は、PCR の円滑な進行に影響を与えます。標的配列に二次構造が存在するかどうかを事前に予測し、その領域を避けるようにプライマーを設計します。
7. プライマー自体およびプライマー間では、連続する相補的塩基を避けるように努める必要があります。
プライマー自体とプライマーの間に連続した 4 塩基の相補性が存在することはできません。プライマー自体に相補的な配列があってはなりません。そうでないと、プライマー自体が折りたたまれてヘアピン構造を形成し、プライマーとテンプレートのアニーリングの組み合わせに影響を及ぼします。
上流プライマーと下流プライマーの間に相補的な配列は存在できません。プライマー間の相補性によりプライマーダイマーが生成され、PCR 効率が低下し、さらには定量精度に影響を及ぼします。プライマーダイマー構造やヘアピン構造が避けられない場合は、△G 値が高すぎないようにします(4.5 kcal/mol 未満にする必要があります)。
8. プライマーは標的特異的産物を増幅します。
qPCR 検出の最終目標は、標的遺伝子の存在量を理解することです。非特異的な増幅が発生すると、定量が不正確になります。したがって、プライマーを設計した後、BLAST によってテストする必要があり、生成物の特異性が配列データベースで比較されます。
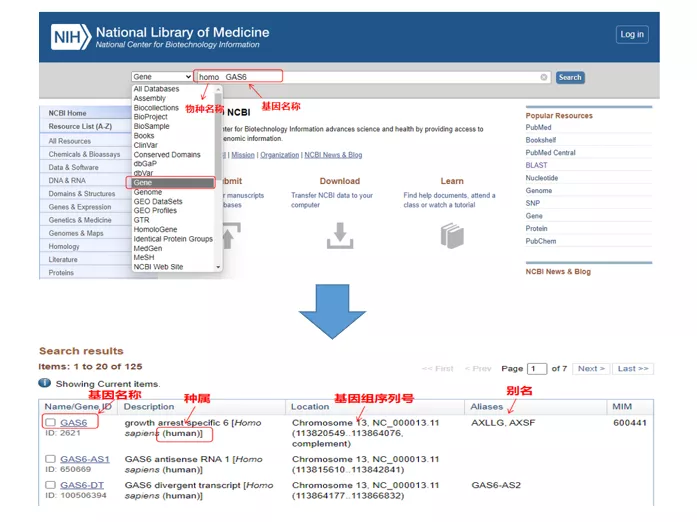
次に、ヒト GAS6 (成長停止特異的 6) 遺伝子を例として、qPCR プライマーを設計します。
01 クエリ遺伝子
ホモ GAS6NCBI を通じて。ここでは、遺伝子名と種が一致していることを確認するために比較することに注意する必要があります。
 02 遺伝子配列を調べる
02 遺伝子配列を調べる
(1) ターゲット配列がゲノム DNA の場合、最初の配列 (遺伝子のゲノム DNA 配列) を選択します。
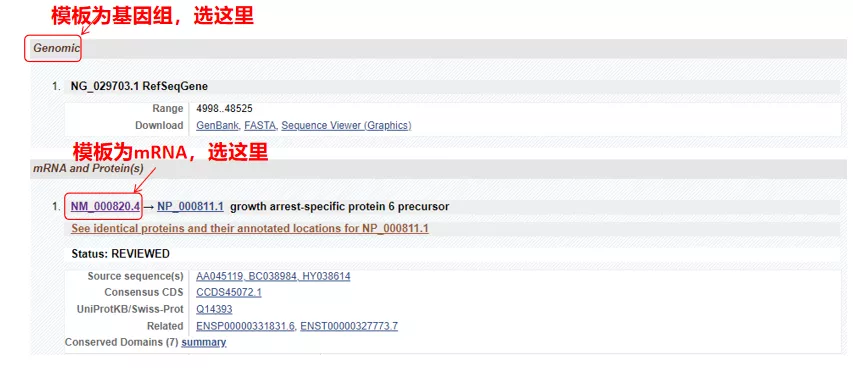 (2) ターゲット配列が mRNA の場合は、2 番目の配列を選択します。入力後、下表の「CDS」をクリックします。茶色の背景の配列は遺伝子のコード配列です。
(2) ターゲット配列が mRNA の場合は、2 番目の配列を選択します。入力後、下表の「CDS」をクリックします。茶色の背景の配列は遺伝子のコード配列です。
 03 デザイン入門
03 デザイン入門
Primer-BLAST インターフェイスに入る
 左上に遺伝子配列番号または Fasta 形式の配列を入力し、関連するパラメーターを入力します。
左上に遺伝子配列番号または Fasta 形式の配列を入力し、関連するパラメーターを入力します。
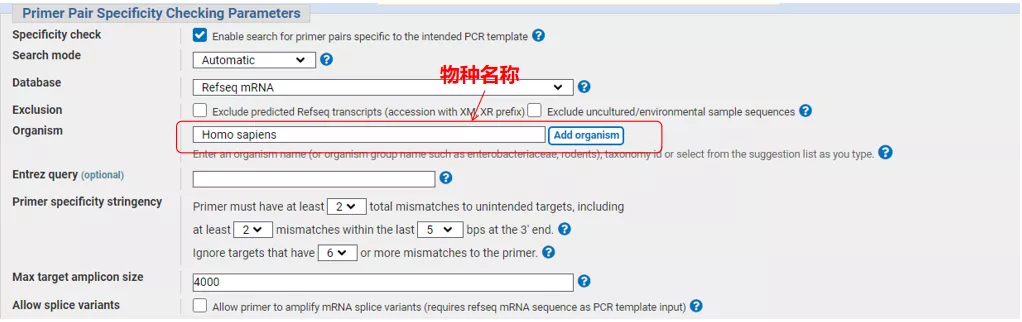
「Get primers」をクリックすると、NCBI がポップアップ表示され、そのようなパラメーターの選択が他のスプライシング バリアントに増幅されることが通知されます。さまざまなスプライシング バリアントをチェックし、それらを送信して、適切なプライマー ペアを取得できます (下の図を参照)。このプロセスの実行には数十秒かかる場合があります。
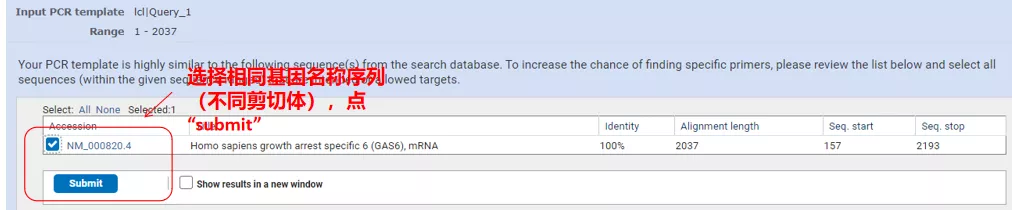
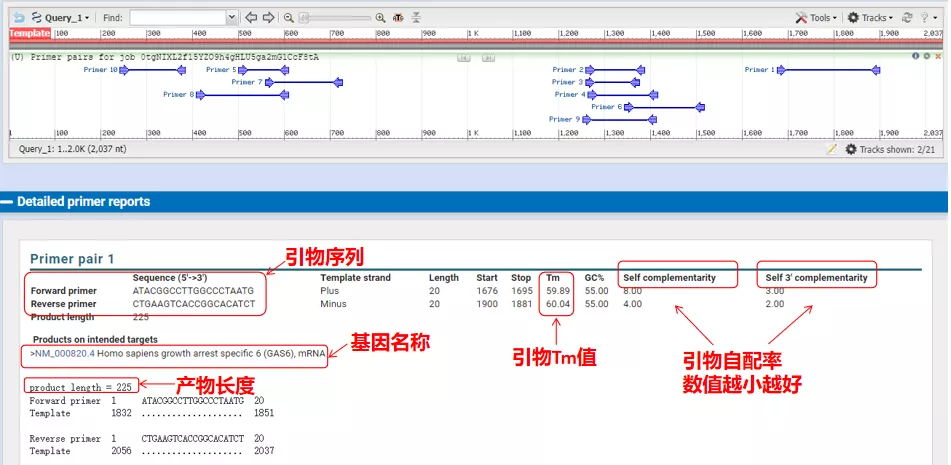 これらのプライマーペアのアニーリング温度はすべて約 60°C です。実験の目的に応じて、適度な長さ、特異性の良い、自己相補性の少ないプライマーを選択して実験すると成功率が非常に高くなります。
これらのプライマーペアのアニーリング温度はすべて約 60°C です。実験の目的に応じて、適度な長さ、特異性の良い、自己相補性の少ないプライマーを選択して実験すると成功率が非常に高くなります。
04プライマー特異性の検証
実際、Primer-Blast では、プライマーの設計に加えて、自社で設計したプライマーを評価することもできます。プライマー設計ページに戻り、設計した上流プライマーと下流プライマーを入力します。その他のパラメーターは調整されません。送信後、プライマーのペアが他の遺伝子にも存在するかどうかを確認できます。それらのすべてが増幅したい遺伝子上に表示されている場合、このプライマーのペアの特異性が優れていることを示しています。(たとえば、これはプライマー クエリの唯一の結果です。)
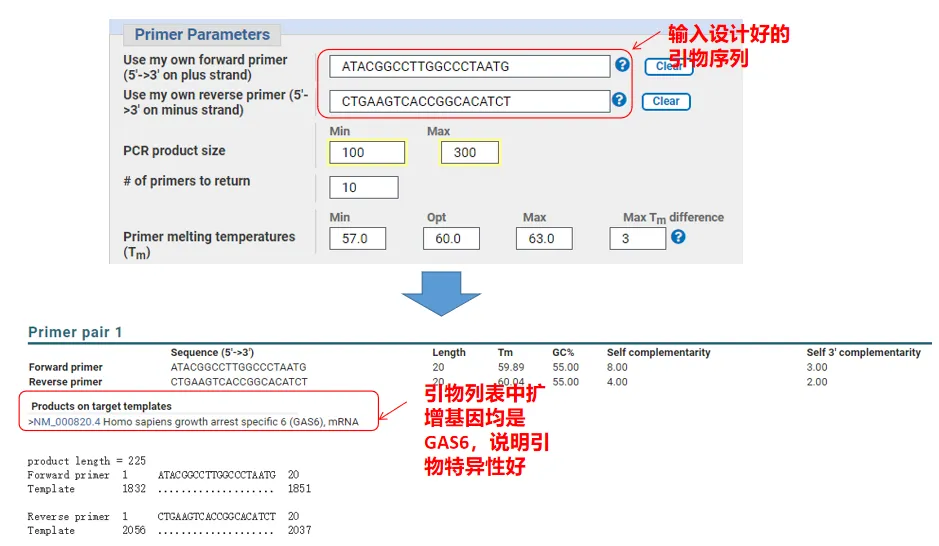
05 プライマーの良否判定
「水準以上の増幅効率」「増幅産物の特性」「信頼できる実験結果」を兼ね備えた「完璧」なプライマーとはどのようなものなのでしょうか?
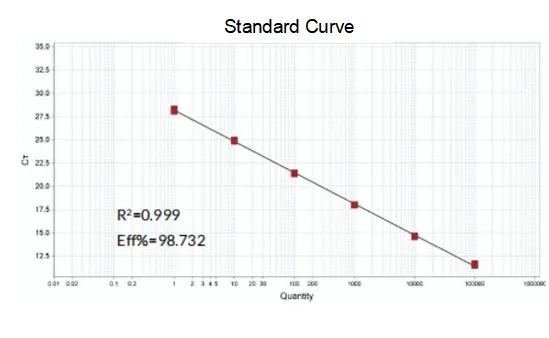 増幅効率
増幅効率
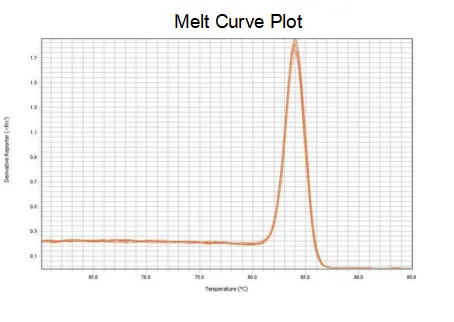 融解曲線
融解曲線
プライマーの増幅効率は 90% ~ 110% に達し、増幅効率が良好であることを意味し、融解曲線は単一ピークを持ち、通常 Tm > 80°C であるため、増幅特異性が良好であることを意味します。
関連製品:
リアルタイム PCR Easy – SYBR GREEN I
リアルタイム PCR Easy-Taqman
投稿日時: 2023 年 2 月 10 日








