免疫グロブリン (Ig) とも呼ばれる抗体は、抗原に特異的に結合する糖タンパク質です。
従来の抗体製剤は動物に免疫を与え、抗血清を採取することによって製造されます。したがって、抗血清には通常、血清中の他の無関係な抗原および他のタンパク質成分に対する抗体が含まれています。一般的な抗原分子には複数の異なるエピトープが含まれることが多く、従来の抗体も複数の異なるエピトープに対する抗体の混合物となります。同じエピトープに対する従来の血清抗体であっても、依然として異なる B 細胞クローンによって産生される異種の抗体で構成されています。したがって、従来の血清抗体はポリクローナル抗体、または略してポリクローナル抗体とも呼ばれます。
モノクローナル抗体 (モノクローナル抗体) は、単一の B 細胞クローンによって産生され、特定のエピトープのみを対象とする非常に均一な抗体です。通常、ハイブリドーマ技術によって調製されます。ハイブリドーマ抗体技術は細胞融合技術に基づいており、特定の抗体を分泌する能力を持つ B 細胞と無限の増殖能力を持つ骨髄腫細胞を組み合わせて B 細胞ハイブリドーマを形成します。このハイブリドーマ細胞は親細胞の特徴を持っています。骨髄腫細胞のように、インビトロで無制限かつ不死的に増殖することができ、脾臓リンパ球のように特異的抗体を合成して分泌することができます。クローニングにより、単一のハイブリドーマ細胞に由来するモノクローナル株、すなわちハイブリドーマ細胞株を取得することができる。それが産生する抗体は、同じ抗原決定基に対する非常に均質な抗体、つまりモノクローナル抗体です。
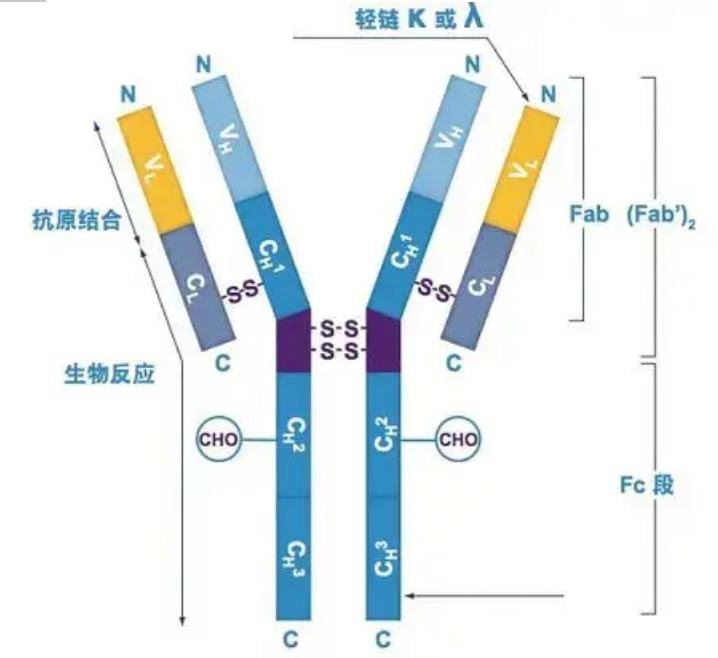
抗体は、1 つまたは複数の Y 字型モノマー (つまり、モノクローナル抗体またはポリクローナル抗体) として存在します。各 Y 字型モノマーは、2 つの同一の重鎖と 2 つの同一の軽鎖を含む 4 つのポリペプチド鎖で構成されています。軽鎖と重鎖は分子量に応じて名前が付けられます。Y字型構造の上部は可変領域であり、抗原結合部位です。(詳細バイオモノクローナル抗体コンセプトより抜粋)
抗体の構造
 重鎖
重鎖
哺乳類の Ig 重鎖には 5 種類あり、ギリシャ文字 α、δ、ε、γ、μ で名付けられています。対応する抗体は、IgA、IgD、IgE、IgG、および IgM と呼ばれます。重鎖が異なれば、サイズと組成も異なります。αとγには約450個のアミノ酸が含まれており、μとεには約550個のアミノ酸が含まれています。
各重鎖には、定常領域と可変領域の 2 つの領域があります。同じ種類の抗体はすべて同じ定常領域を持っていますが、異なる種類の抗体には違いがあります。重鎖 γ、α、δ の定常領域は、柔軟性を高めるためのヒンジ領域を備えた 3 つの Ig ドメインが直列に並んで構成されています。重鎖μおよびεの定常領域は4つのIgドメインで構成されています。異なるB細胞によって産生される抗体の重鎖の可変領域は異なりますが、同じB細胞または細胞クローンによって産生される抗体の可変領域は同じであり、各重鎖の可変領域の長さは約110アミノ酸です。, そして単一のIgドメインを形成します。
軽鎖
哺乳類には、ラムダ型とカッパ型の 2 種類の軽鎖しかありません。各軽鎖には、定常領域と可変領域という 2 つの連結ドメインがあります。軽鎖の長さは約211~217アミノ酸です。各抗体に含まれる 2 つの軽鎖は常に同じです。哺乳動物の場合、各抗体の軽鎖はカッパまたはラムダの 1 種類のみです。軟骨魚類(軟骨魚類)や硬骨魚類などの一部の下等脊椎動物では、イオタ(iota)タイプなどの他のタイプの軽鎖も見られます。
FabおよびFcセグメント
Fc セグメントは、酵素または蛍光色素と直接結合して抗体を標識できます。これは、ELISA プロセス中に抗体がプレート上にリベットで固定される部分であり、免疫沈降、免疫ブロッティング、および免疫組織化学において 2 番目の抗体が認識されて結合する部分でもあります。抗体は、パパインなどのタンパク質分解酵素によって 2 つの F(ab) セグメントと 1 つの Fc セグメントに加水分解されるか、ペプシンによってヒンジ領域から切断されて 1 つの F(ab)2 セグメントと 1 つの Fc セグメントに加水分解されます。IgG 抗体フラグメントは非常に役立つ場合があります。Fc セグメントが欠如しているため、F(ab) セグメントは抗原とともに沈殿せず、in vivo 研究において免疫細胞によって捕捉されません。分子フラグメントが小さく、架橋機能が欠如している(Fc セグメントがないため)ため、Fab セグメントは通常、機能研究における放射性標識に使用され、Fc セグメントは主に組織化学的染色におけるブロッキング剤として使用されます。
可変領域と定常領域
可変領域(V領域)は、H鎖のN末端付近の1/5または1/4(アミノ酸残基約118残基を含む)、L鎖のN末端付近の1/2(アミノ酸残基約108〜111残基を含む)に位置します。各 V 領域には鎖内ジスルフィド結合によって形成されたペプチド環があり、各ペプチド環には約 67 ~ 75 個のアミノ酸残基が含まれています。V 領域のアミノ酸の組成と配置によって、抗体の抗原結合特異性が決まります。V 領域のアミノ酸の種類と配列は常に変化しているため、異なる結合抗原特異性を持つ多くの種類の抗体が形成される可能性があります。L鎖およびH鎖のV領域は、それぞれVLおよびVHと呼ばれます。VL と VH では、一部の局所領域のアミノ酸組成と配列がより高度に変動します。これらの領域は超可変領域 (HVR) と呼ばれます。V 領域の非 HVR 部分のアミノ酸組成と配置は比較的保存的であり、フレームワーク領域と呼ばれます。VL には 3 つの超可変領域があり、通常はそれぞれアミノ酸残基 24 ~ 34 および 89 ~ 97 に位置します。VL、VH の 3 つの HVR をそれぞれ HVR1、HVR2、HVR3 と呼びます。X 線結晶回折の研究と分析により、超可変領域は実際に抗体抗原が結合する場所であることが証明されたため、相補性決定領域 (CDR) と呼ばれています。VL、VH の HVR1、HVR2、HVR3 をそれぞれ CDR1、CDR2、CDR3 と呼ぶこともできます。一般に、CDR3 は高度な超可変性を持っています。超可変領域は、Ig 分子のイディオタイプ決定基が存在する主な場所でもあります。ほとんどの場合、H 鎖は抗原への結合においてより重要な役割を果たします。
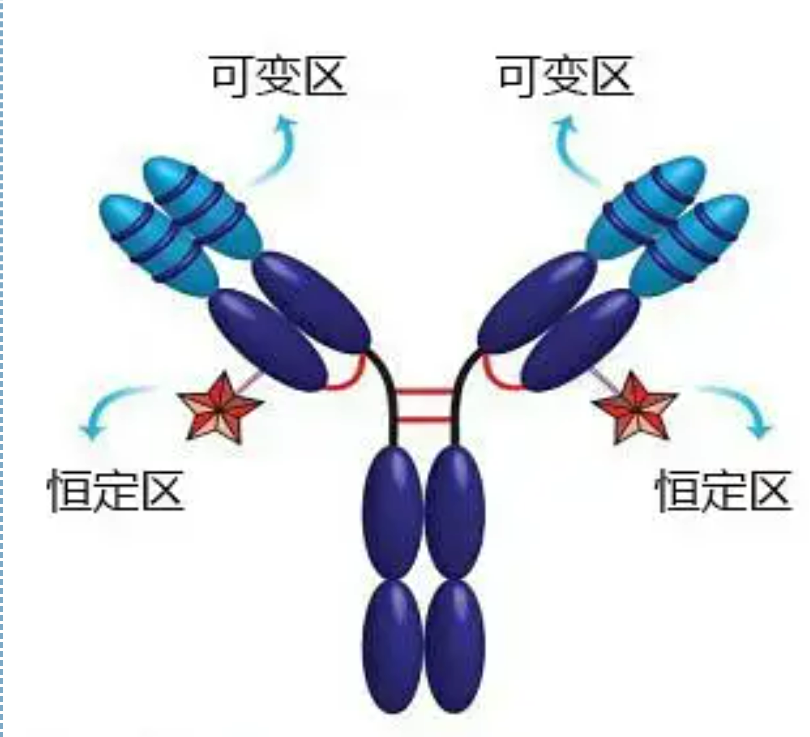 定常領域(C領域)は、H鎖のC末端付近の3/4または4/5(およそアミノ酸119からC末端まで)、L鎖のC末端付近の1/2(約105アミノ酸残基を含む)に位置します。H鎖の各機能領域には約110個のアミノ酸残基が含まれており、ジスルフィド結合で結合した50〜60個のアミノ酸残基からなるペプチド環が含まれています。この領域のアミノ酸組成および配列は、同じ動物IgアイソタイプL鎖および同じタイプH鎖において比較的一定である。同じ、対応する抗原にのみ特異的に結合することができますが、C 領域の構造は同じであり、同じ抗原性を持っています。ウマ抗ヒト IgG 二次抗体 (または抗抗体) は、異なる外毒素に対する 2 つの抗体 (IgG) の組み合わせと組み合わせることができます。これは、二次抗体を調製し、フルオレセイン、同位体、酵素、その他の標識抗体を適用するための重要な基礎です。
定常領域(C領域)は、H鎖のC末端付近の3/4または4/5(およそアミノ酸119からC末端まで)、L鎖のC末端付近の1/2(約105アミノ酸残基を含む)に位置します。H鎖の各機能領域には約110個のアミノ酸残基が含まれており、ジスルフィド結合で結合した50〜60個のアミノ酸残基からなるペプチド環が含まれています。この領域のアミノ酸組成および配列は、同じ動物IgアイソタイプL鎖および同じタイプH鎖において比較的一定である。同じ、対応する抗原にのみ特異的に結合することができますが、C 領域の構造は同じであり、同じ抗原性を持っています。ウマ抗ヒト IgG 二次抗体 (または抗抗体) は、異なる外毒素に対する 2 つの抗体 (IgG) の組み合わせと組み合わせることができます。これは、二次抗体を調製し、フルオレセイン、同位体、酵素、その他の標識抗体を適用するための重要な基礎です。
関連製品:
Cell Direct RT-qPCR キット
投稿時間: 2021 年 9 月 30 日








