四川大学生命科学部の顧客は、Foregene の製品を使用したインパクトファクター 17.848 の高得点の論文を発表しました。
最近、四川大学生命科学部の Song Xu チームは、次のタイトルの表紙論文を発表しました。凝固第 VII、IX、および X 因子は、Cell Research における薬剤耐性グラム陰性菌に対する抗菌タンパク質です。
Cell Research は、中国科学院と学術界で非常に権威のある英国ネイチャー出版グループが共同発行する国際ジャーナルです。
この論文が公開されると、すぐに学界にセンセーションを巻き起こしました。これまでのところ、研究結果は新華社通信、ワールドワイドウェブ、フェニックスネット、南大都市報、Biological Valley、British Daily Mail、American Daily Science、EurekAlert1!、Springer Nature、Phys.org など。、BioMedCentral やその他の著名な学術誌には広範な報告が掲載されており、この研究結果に対する世界の注目は今も高まっています。
この論文は、凝固カスケードの開始に役割を果たす 3 つの凝固因子 VII、IX、および X は、新しいタイプの内因性宿主抗菌タンパク質である、つまり、凝固因子 VII、IX、および X は凝固プロセスにおいて重要な役割を果たしていると指摘しました。また、緑膿菌やアシネトバクター・バウマニなどの耐性の高い「スーパーバクテリア」を含むグラム陰性菌にも対抗できる可能性があります。
この記事の責任著者である Song Xu 氏は次のように述べています。従来、血栓症の原因は凝固因子であると一般に考えられていましたが、今回の研究により、凝固因子には滅菌という特別な効果があることが明らかになりました。国内外で初の発見です」
研究の背景
周知のとおり、細菌耐性は世界中で深刻な公衆衛生問題となっています。関連データによると、毎年世界中で 100 万人近くが薬剤耐性菌感染症により死亡しています。より良い解決策がなければ、2050 年以降の毎年の死亡者数は 1,000 万人になるでしょう。
抗生物質の乱用と、細菌の優れた進化能力により、抗菌薬で死滅するはずだった一部の病原菌が薬剤耐性を獲得し、ほぼ破壊不可能な「スーパー細菌」となった。
また、グラム陽性菌(Gram+)に比べ、陰性菌(Gram-)は外膜(主成分はLPS、別名エンドトキシン、リポ多糖)の存在により死滅しにくくなっています。外膜は、細胞内膜、薄い細胞壁、細胞外膜から構成されるエンベロープです。
研究経緯
Song Xu のチームは、悪性腫瘍の治療における凝固因子の効果を研究していましたが、2009 年に、凝固因子が細菌を殺すことができることが予想外に発見されました。凝固因子の殺菌機構を解明するため、研究開始から論文発表まで10年の歳月を要した。
偶然見つけた
2009 年、研究者らは、十数種類の凝固因子のうち、凝固第 VII 因子が大腸菌と戦うことができることを偶然発見しました。
大腸菌は細菌の中ではグラム陰性菌に属します。このタイプの細菌は、細胞が内側の細胞膜、薄い細胞壁、外側の細胞膜を持っているため、対処が困難です。エンベロープは薬物の侵入を防ぎ、細菌の「侵入」を防ぎます。
仮定を提案する
凝固因子は、血液凝固に関与する血液中のタンパク質のグループです。人体の損傷により出血が生じると、さまざまな凝固因子が段階的に活性化されてフィブリンフィラメントが形成され、血小板とともに傷口が密閉されます。1 つまたは複数の凝固因子が欠如すると、凝固障害が発生します。

科学者たちは、凝固障害のある患者は敗血症や肺炎などの細菌性疾患にかかりやすいことに気づいています。この関連性から、彼らは、凝固因子が凝固プロセスにおいて重要な役割を果たすだけでなく、抗感染効果も有するのではないかと推測しました。
徹底的な研究
凝固因子がより広範囲のグラム陰性菌に対処できるかどうかを調べるために、研究者はその抗菌メカニズムを詳しく研究し始めました。彼らは、凝固第 VII 因子と構造的に類似した第 IX 因子および第 X 因子、これら 3 つのタンパク質がグラム陰性菌の固体エンベロープを突破できることを発見しました。
既存の抗菌物質の多くは細胞代謝や細胞膜を標的としていますが、これら 3 つの凝固因子は作用機序が異なります。これらは細菌の外膜の主成分である LPS を加水分解することができます。LPSが失われると、グラム陰性菌が生存することが困難になります。
さらに進んでください
研究チームはそのメカニズムをさらに調査し、次のことを発見しました。凝固因子タンパク質は軽鎖成分を通じて細菌に作用しますが、重鎖成分には抗菌作用がありません。
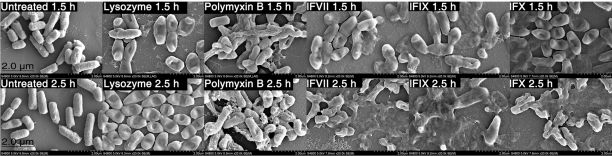
研究者らは、実験室の培養環境において、凝固因子またはその軽鎖成分を添加した後、最初に細菌細胞のエンベロープが損傷し、その後 4 時間以内に細菌細胞全体がほぼ完全に破壊されたことを明確に観察しました。
培養大腸菌に第VII因子軽鎖成分を添加し、
細菌の外膜成分が損傷し、細胞が破壊される
大腸菌だけでなく、緑膿菌やアシネトバクター・バウマニなど、検査した他のグラム陰性菌も「征服」された。これらの細菌は両方とも、薬剤耐性があるため、世界保健機関 (WHO) によって人間の健康に対して最も脅威となる 12 の細菌としてリストされています。
実験による検証
次の動物実験では、スーパーバクテリアに対する凝固因子の有効性がさらに検証されました。
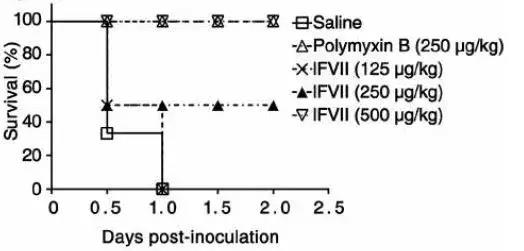
研究者らは、薬剤耐性のある緑膿菌またはアシネトバクター・バウマンニを大量にマウスに接種した。高用量の第 VII 因子軽鎖を注射した後、マウスは生存しました。一方、生理食塩水を注射された対照群のマウスは、数時間後に感染により24匹全員死亡した。
スーパーバクテリア感染後、第VII因子軽鎖注入
保護的な役割を果たし、マウスの生存率を大幅に向上させることができます
意義
現在のところ、LPS を加水分解して効果を発揮する抗菌物質は知られていません。
LPSの加水分解に基づく抗菌メカニズムと凝固因子の抗菌特性の解明と、これらの凝固因子を低コストで大規模に生産できる能力を組み合わせることで、薬剤耐性のあるグラム陰性菌と戦うための費用対効果の高い新しい戦略が提供される可能性がある 公衆衛生上の緊急危機が引き起こされた。
さらに、この研究は臨床現場での幅広い応用の可能性も秘めています。現在のところ、LPSを加水分解して効果を発揮する抗菌薬は知られていない。FVII、FIX、FX の LPS に対する抗菌特性と低コストの大規模生産を組み合わせることで、「スーパーバクテリア」感染症に対する新薬の開発が期待されています。
トピックの拡張
「スーパーバクテリア」という名前の方がよく知られていますが、正確には「多剤耐性菌」というべきで、複数の抗生物質に耐性を持つ細菌の一種を指します。
前述したように、現在細菌の耐性が増加しているのは、主に抗生物質の不当な使用、さらには乱用によるものです。たとえば、気道感染症の治療における広域抗生物質の高頻度使用。
気道感染症は私たち全員がよく知っている病気です。統計によると、子供は年に約6~9回、青少年と成人は年に約2~4回感染します。
気道感染症は救急外来であることが多いため、救急医が患者と向き合う際の最大の難点は、病原性情報を短時間で入手できないことである。したがって、病原体検査の遅れにより、臨床医は(効果がある可能性がある)広域抗生物質に頼らざるを得なくなります。多くの種類の細菌に対応)。
この「大きな網を広げる」投薬方法が、細菌獲得薬剤耐性というますます深刻な問題を引き起こしています。なぜなら、感受性のある菌株の大部分が死滅し続けると、感受性のある菌株に代わって薬剤耐性菌が増殖し、薬剤に対する細菌の耐性率が増加し続けるからです。
したがって、医師が適切な薬を処方できるよう、正確な病原体検出レポートを短期間で取得できれば、広域抗生物質の使用を大幅に削減でき、細菌耐性の問題を軽減できます。
この実際的な問題に直面して、富士科学研究チームは 15 項目の呼吸器病原体検出キットの開発に着手しました。
このキットは、ダイレクト PCR 技術とマルチプレックス PCR 技術の組み合わせを採用しており、喀痰中の肺炎球菌、メチシリン耐性黄色ブドウ球菌、インフルエンザ菌、その他の一般的な下気道 15 種類を約 1 時間で検出できます。病原性細菌は、定着細菌 (通常の細菌) と病原性細菌を効果的に区別できます。臨床医による正確な薬剤使用を支援する有効なツールとして期待されていると思います。
全人類の公共の敵である「スーパーバクテリア」を前に、人類は決してそれを軽視しませんでした。生命科学の分野では、Song Xu のチームのように、「スーパー バクテリア」の解決策を見つけるために懸命に探究し、黙々と研究に取り組んでいる研究者がまだたくさんいます。
ここで、フォーチュン・バイオテックは、生物学的同業者とその受益者を代表して、この研究に尽力し、汗を流したすべての科学者に最大限の敬意を表するとともに、人類ができるだけ早く「スーパーバクテリア」に打ち勝ち、より安全で健康的な生活を送れるよう祈りたいと思います。周囲。
投稿時間: 2021 年 6 月 25 日