概要
トランスジェニック植物の迅速な同定
文/トン・ユーチェン
実験運用/ハン・イン
編集者/ウェン・ユージュン
単語/1600+
推奨読書時間/8~10分
トランスジェニック植物の迅速な同定
研究室の新参者にとって、変換率の低い植物の束から陽性の植物を選り分けるのは良い仕事ではありません。まず、大量のサンプルからDNAを一つ一つ抽出し、PCRによって外来遺伝子を検出します。ただし、結果は空白や数個の帯が表示される場合が多く、検出漏れか誤検出かを判断することはできません。。このような実験のプロセスと結果に直面するのは非常に無力でしょうか?心配しないでください。兄弟が、トランスジェニック陽性植物を簡単かつ正確に選別する方法を教えます。
ステップ1: 検出プライマーを設計する
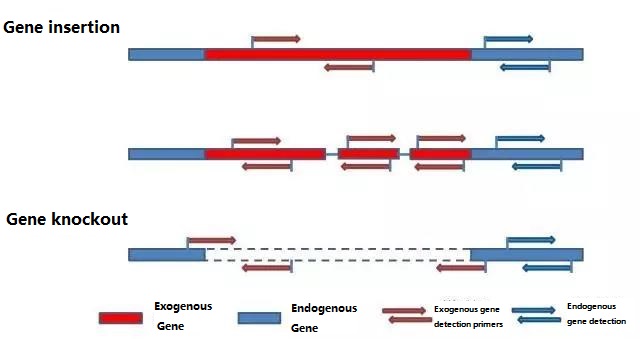
検査対象のサンプルに応じて検出対象の内因性遺伝子と外来遺伝子を決定し、その遺伝子内の代表的な100~500bpの配列を選択してプライマーを設計します。優れたプライマーは、検出結果の精度を保証し、検出時間を短縮します (一般的に使用される検出プライマーについては付録を参照)。
ノート:
新たに設計したプライマーは、大規模な検出を実行する前に、反応条件を最適化し、検出の精度、精度、検出限界を検証する必要があります。
ステップ2:実験プロトコルの開発

ポジティブコントロール:目的断片を含む精製DNAを鋳型として、PCR反応系や反応条件が正常かどうかを判定します。
ネガティブ/ブランク コントロール: DNA テンプレートまたは ddH を使用します。2PCR システムに汚染源があるかどうかを検出するためのテンプレートとしてターゲット フラグメントを含まない O。
内部参照コントロール: テストするサンプルの内因性遺伝子のプライマー/プローブの組み合わせを使用して、テンプレートが PCR で検出できるかどうかを評価します。
ノート:
実験結果の妥当性を評価するには、陽性、陰性/ブランク対照および内部対照対照を試験ごとに設定する必要があります。
ステップ3: 実験の準備

使用前に、溶液が均一に混合されているかどうかを確認してください。沈殿物が見つかった場合は、使用前に指示に従って溶解および混合する必要があります。2×PCR ミックスは、不均一なイオン分布を避けるために、使用前にマイクロピペットで繰り返しピペッティングして混合する必要があります。
ノート:
説明書を取り出してよく読み、指示に従って実験前の準備をしてください。
ステップ4:PCR反応系の準備
実験プロトコールに従って、プライマーを混合します。2O、2×PCR混合物を遠心分離し、各反応チューブに分配する。
ノート:
大規模または長期の検査には、PCR 産物によるエアロゾル汚染を効果的に回避できる UNG 酵素を含む PCR 反応システムの使用をお勧めします。
ステップ 5: 反応テンプレートを追加する

ダイレクト PCR 技術を使用するため、面倒な核酸精製プロセスは必要ありません。サンプルテンプレートは 10 分以内に調製され、対応する PCR 反応システムに追加されます。
ノート:
Lysis 法の方が検出効果が高く、得られた生成物は複数の検出反応に使用できます。
5.1: 葉の直接 PCR
マニュアルの写真のサイズに従って、葉の組織を直径 2 ~ 3 mm に切り取り、PCR 反応システムに置きます。
注: 葉の断片が PCR 反応溶液に完全に浸されていることを確認し、過剰な葉組織を加えないでください。
5.2: 葉の溶解法
葉の組織を直径5〜7mmに切り、遠沈管に入れます。成熟した葉を選択する場合は、葉の主脈の組織の使用を避けてください。50μlの緩衝液P1ライセートをピペットで遠心分離管に移し、ライセートが葉組織を完全に浸すことができることを確認し、サーマルサイクラーまたは金属バスに置き、95℃で5〜10分間溶解する。


50μlの緩衝液P2中和溶液を加え、よく混合する。得られたライセートをテンプレートとして使用し、PCR 反応システムに追加できます。
注: テンプレートの量は PCR システムの 5 ~ 10% である必要があり、20% を超えてはなりません (たとえば、20 μl PCR システムでは、1 ~ 2 μl の溶解バッファーを追加します。4 μl を超えない)。
ステップ6:PCR反応

PCR 反応チューブを遠心分離した後、増幅のために PCR 装置に置きます。
ノート:
この反応では増幅に非精製テンプレートを使用するため、増幅サイクル数は精製 DNA テンプレートを使用する場合より 5 ~ 10 サイクル多くなります。
ステップ 7:電気泳動の検出と結果の分析

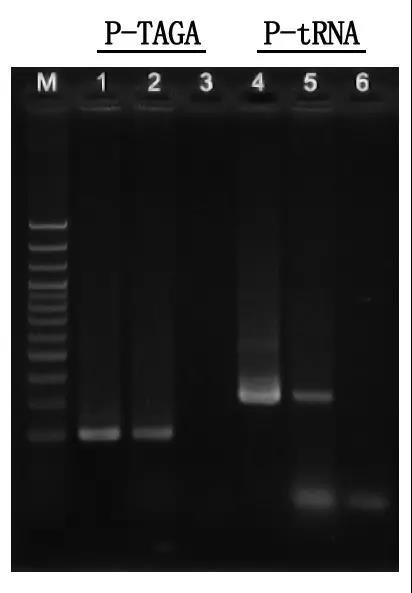
M:100bp DNAラダー
1\4: 精製DNA法
2\5:ダイレクトPCR法
3\6: ブランクコントロール
品質管理:
実験で設定した各種コントロールのテスト結果は、以下の条件を満たす必要があります。それ以外の場合は、問題の原因を分析し、問題を取り除いた後に再度テストを実行する必要があります。
表 1. さまざまな対照群の正常なテスト結果

※プラスミドを陽性対照として使用した場合、内因性遺伝子検査結果が陰性となる場合があります。
結果判定:
A. サンプルの内因性遺伝子の検査結果が陰性であり、通常のPCR検出に適したDNAがサンプルから抽出できないか、抽出されたDNAにPCR反応阻害物質が含まれているため、再度DNAを抽出する必要があります。
B. 試料の内因性遺伝子の検査結果が陽性、外因性遺伝子の検査結果が陰性であることは、試料から通常のPCR検出に適したDNAが抽出されていることを示しており、試料中にXXX遺伝子が検出されないと判断できる。
C. 検体の内因性遺伝子の検査結果が陽性、外因性遺伝子の検査結果が陽性であることは、検体から通常のPCR検出に適したDNAが抽出されており、検体のDNAにはXXX遺伝子が含まれていることを示します。さらに確認実験を行うことも可能です。
ステップ 8: 検出プライマーを設計する

実験後は、環境汚染を防ぐために、2%次亜塩素酸ナトリウム溶液と70%エタノール溶液を使用して実験エリアを拭きます。
付録
表 2. 遺伝子組み換え植物の一般的な PCR 検出に一般的に使用されるプライマー
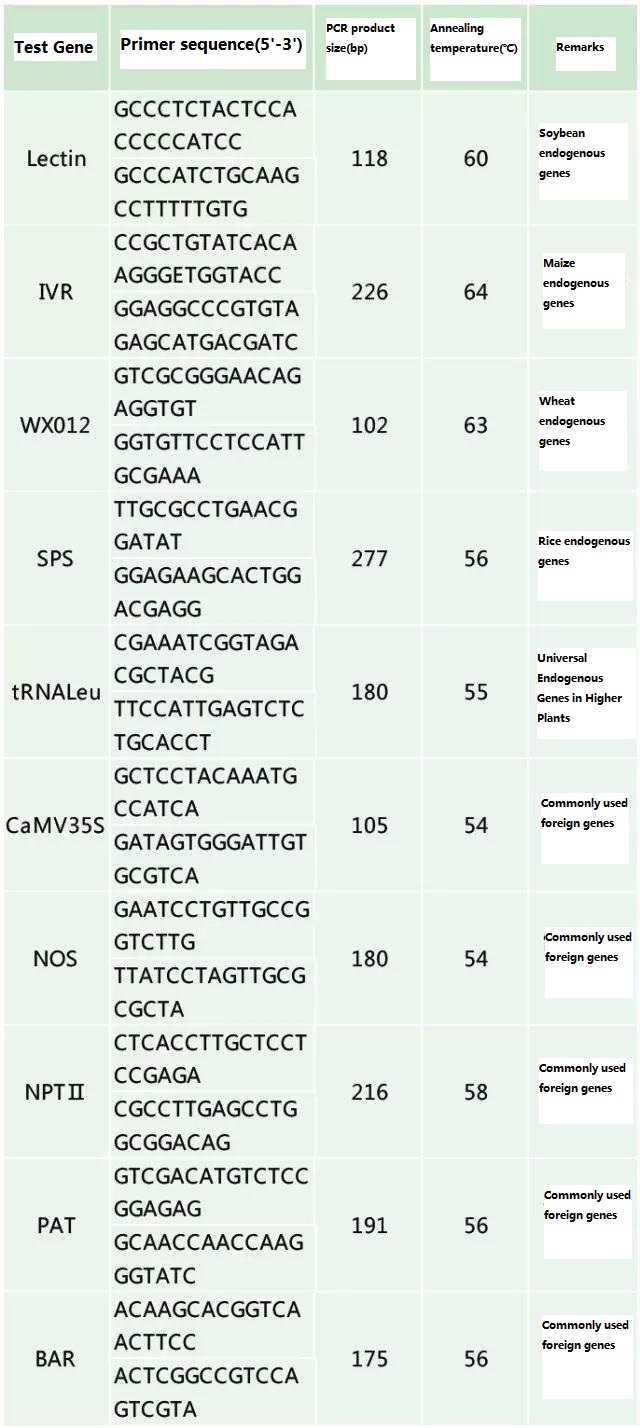
参考資料:
SN/T 1202-2010、食品中の遺伝子組み換え植物成分の定性的 PCR 検出法。
農業省発表 1485-5-2010、遺伝子組み換え植物およびその製品、米 M12 およびその誘導体の成分の検査。
投稿時間: 2021 年 6 月 9 日








