PCR, 多数 PCR, インサイチュPCR, リバースPCR, RT-PCR, qPCR(1)–PCR
各種PCRの概念、手順、詳細を整理します
Ⅰ. PCR
PCR と呼ばれるポリメラーゼ連鎖反応は、特定の DNA 断片を拡大するために使用される分子生物学的技術です。これは、in vitro での特別な DNA 複製とみなすことができます。DNA ポリメラーゼ (DNA ポリメラーゼ I) は 1955 年にはすでに発見されており、実験的価値と実用性を備えた大腸菌のクレノウ断片は 1970 年代初頭に H. クレノウ博士によって発見されましたが、この酵素は温度に耐えられず、高温により変性する可能性があるため、高温変性を伴うポリメラーゼ連鎖反応には適合しません。現在使われている酵素(Taqポリメラーゼと呼ばれます)は、1976年に温泉細菌のテルマス・アクアティカスから単離されました。高温に強いのが特徴で理想的な酵素ですが、広く使われるようになったのは1980年代以降です。PCR の原始的なプロトタイプの元の概念は、1971 年に KJell Kleppe 博士によって提案された遺伝子の修復とコピーに似ています。彼は、最初の単純かつ短期間の遺伝子コピー (PCR の最初の 2 サイクル反応に似ています) を発表しました。今日開発された PCR は、1983 年に Kary B. Mullis 博士によって開発されました。Mullis 博士はその年、PE 企業に勤務していたため、PE は PCR 業界で特別な地位を占めています。マリス博士は、1985 年に斉木氏らとともに最初の関連論文を正式に発表しました。それ以来、PCR は 1 日に何千マイルも使用されており、関連論文の質の高さにより、他の多くの研究方法が受け入れがたいものになったと言えます。その後、PCR 技術は生物学的科学研究や臨床応用に広く使用され、分子生物学研究の最も重要な技術となっています。マリスは 1993 年にノーベル化学賞も受賞しました。
PCR原理
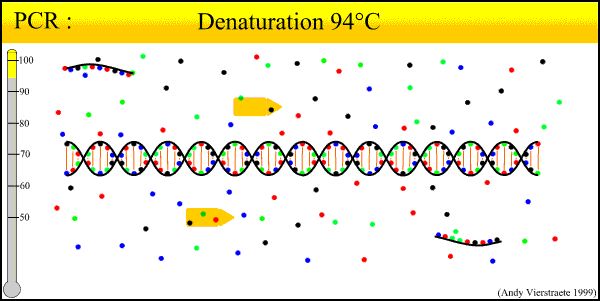
PCR 技術の基本原理は DNA の自然な複製プロセスに似ており、その特異性は標的配列の両端に相補的なオリゴヌクレオチド プライマーに依存します。PCRは、変性-アニーリング-伸長という3つの基本反応ステップから構成されます。 ①鋳型DNAの変性:鋳型DNAを約93℃で一定時間加熱した後、鋳型DNAのPCR増幅によって形成された二本鎖DNAの二重DNA溶液を離れ、プライマーと結合できるように一本鎖にし、次のラウンドの反応に備えます。②鋳型DNAとプライマーのアニーリング(合成):鋳型DNAを加熱して一本鎖に縮退させた後、約55℃まで温度を下げます。プライマーと鋳型DNAの一本鎖の相補配列。③プライマーの伸長:DNAテンプレートとプライマーの結合は、dNTPを反応原料としたTaqDNAポリメラーゼの作用に基づいています。複製の原理を維持し、テンプレート DNA 鎖を補完する新しい半予約コピー鎖を合成し、変性 - アニーリング - 伸長の 3 つのプロセスを繰り返すことで、より多くの「半予約コピー鎖」を得ることができ、この新しい鎖は再び利用可能になり、次のサイクルのテンプレートになります。ループが完了するまでに 2 ~ 4 分かかり、標的遺伝子は 2 ~ 3 時間で数百万回増幅されます。
標準PCR反応システム
| Taq DNA ポリメラーゼ | 2.5μl |
| Mg2+ | 1.5mmol/L |
| 10倍の増幅バッファー | 10μl |
| 4 つの dNTP 混合物 | 200μl |
| テンプレートDNA | 0.1~2μg |
| プライマー | 10~100μl |
| 蒸し水を2倍、3倍加えます。 | 100μl |
PCR反応の5つの要素
PCR反応に関与する物質は主にプライマー、酵素、dNTP、鋳型、バッファー(Mg2+が必要)の5種類です。【PCR手順】
標準的な PCR プロセスは 3 つのステップに分かれています
1. DNA 変性 (90°C ~ 96°C): 熱作用を受けると二本鎖 DNA テンプレートが水素結合を切断し、一本鎖 DNA を形成します。
2. アニーリング (25℃ ~ 65℃): システム温度が低下し、プライマーが DNA テンプレートと結合して局所的な二重鎖が形成されます。
3. 伸長(70℃~75℃):Taq酵素(約72℃、最も活性が高い)の作用下、dNTPを原料としてプライマーの5'末端→3'末端と伸長し、合成と鋳型が相互にDNA鎖を補完します。
各サイクルは変性、アニーリング、伸長され、DNA 含有量が 2 倍になります。現時点では、増幅領域が短いため、Taq 酵素活性が最適でない場合でも、一部の PCR は非常に短時間で複製できるため、2 段階に変更することができます。つまり、アニーリングと伸長を 60 °C ~ 65 °C で同時に行うことができます。持ち上げて冷却する工程を軽減し、応答速度を向上させるため。
PCR反応の特徴
● 高い特異性
PCR 反応の具体的な決め手は次のとおりです。 ① プライマーと鋳型 DNA の特定の組み合わせ。②塩基対形成の原理。③TaqDNAポリメラーゼ合成反応の忠実性。④標的遺伝子の特異性と保存性。
プライマーとテンプレートの正しい組み合わせが鍵です。プライマーとテンプレートの結合およびプライマー鎖の伸長は、アルカリ塩基マッチングの原理に基づいています。ポリメラーゼ合成反応の忠実性と、反応におけるテンプレートとプライマーの結合 (化合物) を形成するための Taq DNA ポリメラーゼの高温耐性により、より高温でも実行できます。組み合わせの特異性が大幅に向上します。クリップは高い正確性を維持できます。保存性の高い標的遺伝子領域を選択することで、その特異性はより高くなります。
●高感度
PCR 産物の生産量はインデックスによって増加します。これにより、ピッカーの開始テンプレート (PG=10-12) が拡張され、マイクロコントローラーのレベルがマイクログラム (μg= -6) のレベルまで増加します。100万個の細胞から目的の細胞を検出できます。ウイルスの検出では、PCR の感度は 3 RFU (空のスポット形成単位) に達します。細菌科学における最小検出率は 3 個の細菌です。
● シンプルかつ高速
PCR リフレクションでは、高温の Taq DNA ポリメラーゼを使用し、反応溶液を一度に添加します。つまり、DNA 増幅溶液とウォーターバスポット上での変性-アニール-伸長反応です。通常、増幅反応は2~4時間で完了します。強化された製品は通常、電気剣によって分析され、同位体を使用する必要がなく、放射性汚染がなく、プロモーションも簡単です。
●試料の純度が低い
ウイルスや細菌を分離して細胞を培養する必要がありません。DNA粗生成物およびRNAは増幅器として使用できます。DNA 増幅検出は、血液、体液、咳洗浄液、毛髪、細胞、生体組織などの臨床検体を使用して直接使用できます。
PCRよくある問題
● 偽陰性、増幅帯域なし
PCR 反応の重要な段階には、① 鋳型核酸の調製、② プライマーの品質と特異性、③ 酵素の品質、④ PCR サイクル条件が含まれます。理由を見つけるには、上記のリンクについても分析して研究する必要があります。
鋳型: ① 鋳型に雑多なタンパク質が含まれている、② 鋳型に Taq 酵素阻害剤が含まれている、③ 鋳型内のタンパク質、特に染色体上のグループタンパク質が除去されていない。⑤デミナー核酸の変性が徹底されていない。酵素とプライマーの品質が良好な場合、増幅バンドは存在しませんが、これはおそらく検体の消化処理によるものと考えられます。鋳型核酸の抽出プロセスには問題があるため、効果的で安定した消化溶液を調製するには、その手順を任意に変更せずに固定する必要があります。
酵素の不活化: 酵素活性が失われたり不十分で偽陰性が生じたりするかどうかを分析するには、新しい酵素、または古い酵素と新しい酵素の両方を一緒に使用する必要があります。Taq 酵素またはエチジウムブロマイドは忘れられる場合があることに注意してください。
プライマー: プライマーの品質、プライマーの濃度、および 2 つのプライマーの濃度が対称的かどうか。これは、PCR の失敗、または増加するバンドが理想的ではなく、拡散しやすい原因の一般的な理由です。一部のバッチ番号のプライマーの品質に問題があります。2 つのプライマーは高濃度と低濃度を備えているため、非対称増幅効率が低くなります。対策としては、 ① ユニット合成に適したプライマーを選択する。② プライマーの濃度はOD値だけでなく、寒天糖ゲル電気泳動を行うためのプライマー原液にも注意を払います。プライマー ストリップ ゾーンが存在し、2 つのプライマーの明るさが全体的に一貫している必要があります。ベルト、PCR はこの時点で失敗する可能性があり、プライマー合成ユニットで解決する必要があります。プライマーの濃度が高いと明度が低くなり、希釈する際には濃度のバランスをとる必要があります。③ 冷蔵庫の多重凍結や長期冷蔵部分を防ぐため、プライマーを高濃度で充填・保管してください。プライマーの劣化・劣化の原因となります。④ プライマーの長さが不足し、プライマー間にジクラスターが形成されるなど、プライマーの設計に無理がある。
Mg2+ 濃度: Mg2+ イオン濃度は PCR 増幅効率に大きな影響を与えます。濃度が高すぎると、PCR 増幅の異性が減少する可能性があります。濃度が低すぎると、PCR 増幅出力によって拡張バンドが得られずに PCR 増幅が失敗することさえあります。
反応量の変更:PCR増幅に使用される量は20μl、30μl、および50μlまたは100μLであり、PCR増幅のアプリケーションの大容量は科学研究と臨床試験のさまざまな目的に応じて設定されます。20μlなどの少量を作った後、サイズを作る際にコードの状態を作らないと失敗します。
物理的な理由: 形質転換は PCR 増幅にとって非常に重要です。変性温度が低く、変性時間が短い場合、偽陰性が発生する可能性が高くなります。アニーリング温度が低すぎると、非特異的増幅が発生し、特異的増幅効率が低下する可能性があります。プライマーとテンプレートの組み合わせに大きな影響を及ぼし、PCR 増幅効率を低下させます。場合によっては、伸長装置または水溶性調理器の変動、アニーリング、および伸長温度を検出するために標準温度計を使用する必要がありますが、これが PCR の失敗の原因の 1 つです。
標的配列バリアント: 標的配列に突然変異や欠失、プロトタイプとテンプレートの組み合わせが発生した場合、または標的配列の欠如により、プライマーとテンプレートは相補的配列を失い、PCR 増幅は成功しません。
● 誤検知
PCR 増幅バンドはターゲット シーケンス バンドと一致しているように見えますが、場合によってはそのバンドがよりきれいで高い場合もあります。
プライマーの設計が適切ではありません。選択した増幅配列と目的外の増幅配列が相同であるため、PCR 増幅を行うと、増幅された PCR 産物は目的外の配列になります。ターゲット配列が短すぎるか、プライマーが短すぎるため、偽陽性が発生する傾向があります。再設計する必要がある。
標的配列または増幅産物の相互汚染: この汚染には 2 つの理由があります。1 つは、ゲノム全体または大きなセグメントの相互汚染であり、偽陽性を引き起こします。この種の偽陽性は、次の方法で解決できます。 操作中は、ターゲット シーケンスがサンプル ガンに吸い込まれたり、遠心管から飛び散ったりしないように、注意深く慎重に行ってください。酵素や高温に耐えられない物質を除き、すべての試薬や器具は高圧で消毒する必要があります。遠心管とサンプルは一度に使用してください。必要に応じて、検体を添加する前に反応管および試薬に紫外線を照射し、既存の核酸を破壊します。第二に、大気汚染中の小さな破片。これらの小さな断片は標的配列よりも短いですが、一定の相同性を持っています。相互に接続することができます。プライマーを補完した後、PCR 産物が拡張される可能性があり、これにより偽陽性の生成が引き起こされます。ネスト PCR 法を削減または排除するために使用できます。
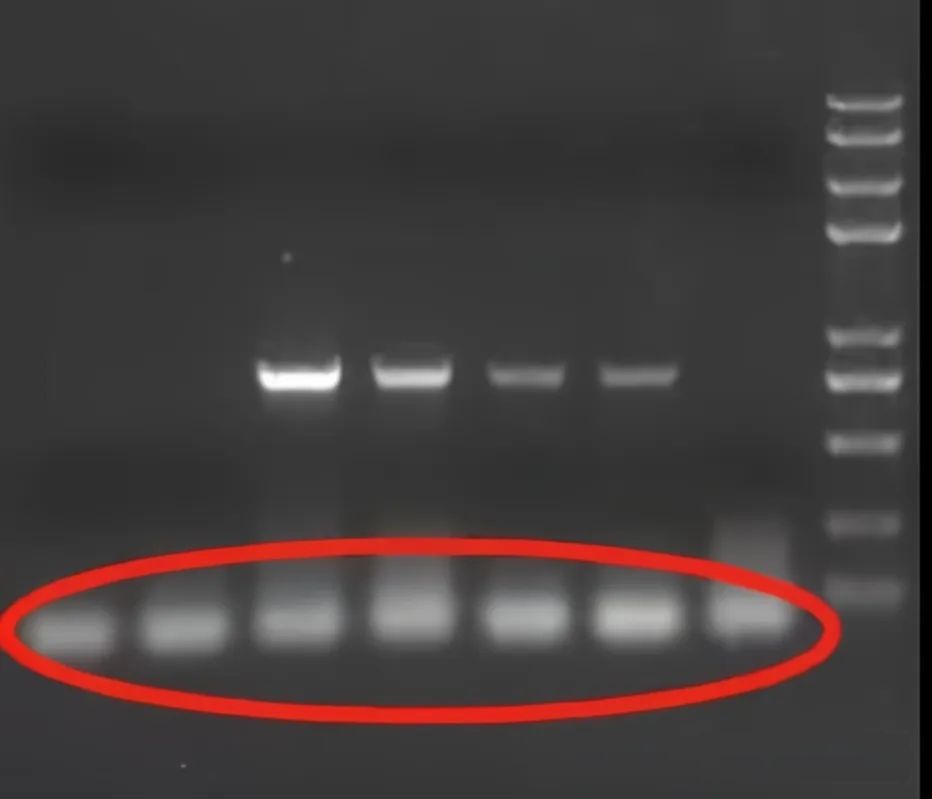
● 非特異的な増幅バンドが現れる
PCR 増幅後に出現したバンドは、予想されたサイズと一致しない、大きいか小さい、または特定の増幅バンドと非特異的な増幅バンドが同時に存在します。非特異的なバンドの出現は次のとおりです。まず、プライマーが標的配列に対して不完全に相補的であるか、またはプライマーが重合してジクラスターを形成しています。2 つ目は、MG2+ イオンの濃度が高すぎること、アニーリング温度が低すぎること、および PCR サイクル数が関係していることです。2つ目は酵素の質と量です。多くの場合、一部のソースの酵素は特別ではないバンドが発生する傾向があり、他のソースの酵素は発生しません。場合によっては、酵素の非特異的増幅も発生します。対策は、必要に応じて魅力を再設計することです。酵素の量を減らすか、別の供給源の酵素と置き換えてください。プライマリーの量を減らし、テンプレートの量を適切に増やし、サイクル数を減らします。アニーリング温度を適切に上げるか、2 温度点法 (93℃ の変性、約 65℃ でのアニーリングおよび伸長) を使用します。
● 剥げたトウまたはスミアテープが現れる
PCR 増幅は、適用されているか、殻に覆われているか、またはカーペット状のベルトのように見えることがあります。その理由としては、酵素の量が多すぎる、または酵素の品質が悪いため、dNTP 濃度が高すぎる、Mg2+ 濃度が高すぎる、アニーリング温度が低すぎる、サイクル数が多すぎるなどが考えられます。対策としては、①酵素の量を減らすか、別の酵素を変える。②dNTP濃度を下げる。 ③Mg2+濃度を適切に下げる。④テンプレートの量を増やし、サイクル数を減らします。
関連製品
◮ より高い忠実度: 通常の Taq 酵素の 6 倍。
◮ 増幅速度の高速化
◮ テンプレートの適応性の向上
◮ より高い増幅効率
◮ 環境耐性がより強い: 37°C に 1 週間置くと、90% 以上の活性が維持されます。
◮ 5'→3' DNA ポリメラーゼ活性と 5'→3' エキソヌクレアーゼ活性を持ちますが、3'→5' エキソヌクレアーゼ活性はありません。
独自の反応システムと高効率 Taq DNA ポリメラーゼにより、PCR 反応の増幅効率、特異性、感度が向上します。
RT-qPCR Easyᵀᴹ (ワンステップ)-SYBR Green I
◮ ワンステップキットは、同じチューブ内で逆転写と qPCR の 2 つの反応を行い、テンプレート RNA、特異的 PCR プライマー、RNase-Free ddH を追加するだけで済みます。2O.
◮ このキットは、ウイルス RNA または微量 RNA を迅速かつ効率的に定量分析できます。
◮ このキットは、独自の Foregene 逆転写試薬と Foregene HotStar Taq DNA ポリメラーゼを独自の反応システムと組み合わせて使用し、増幅効率と反応の特異性を効果的に向上させます。
◮ 最適化された反応システムにより、反応の検出感度が向上し、熱安定性が向上し、耐性が向上します。
◮ RT-qPCR 簡単TM(ワンステップ)-SYBR Green I キットには ROX 内部参照色素が付属しており、ウェル間のシグナルバックグラウンドやシグナルエラーを排除するために使用でき、顧客がさまざまなモデルの定量 PCR 機器で使用するのに便利です。
RTイージーTMⅡ (マスタープレミックス 第一鎖 cDNA 合成リアルタイム PCR)
- 効率的な gDNA 除去能力により、2 分以内にテンプレート内の gDNA を除去できます。
-効率的な逆転写システムにより、ファーストストランド cDNA の合成が完了するまでにわずか 15 分しかかかりません。
- 複雑なテンプレート: GC 含有量が高く、複雑な二次構造を持つテンプレートも高効率で反転できます。
-高感度逆転写システムにより、pgレベルのテンプレートでも高品質なcDNAが得られます。
-逆転写システムは熱安定性が高く、最適反応温度は42℃ですが、50℃でも良好な逆転写性能を維持します。
投稿日時: 2023 年 3 月 18 日