PCR は最も広く使用されている核酸増幅技術であり、その感度と特異性により広く使用されています。しかし、PCR は熱変性を繰り返す必要があり、機器や装置に依存するという限界を取り除くことができず、臨床現場での検査への応用が制限されます。
1990 年代初頭以来、多くの研究室が熱変性を必要としない定温増幅技術の開発を開始しました。現在、ループ媒介等温増幅技術、鎖置換等温増幅技術、ローリングサークル等温増幅技術、核酸配列依存性を開発している。等温増幅技術など。
Loopを介した等温増幅
増幅原理は、DNA が約 65°C で動的平衡状態にあるという事実に基づいています。プライマーが塩基対を形成し、二本鎖 DNA の相補部分まで伸長すると、もう一方の鎖が解離して一本鎖になります。
この温度では、DNA は 4 つの特異的なプライマーを使用して鎖置換 DNA ポリメラーゼに依存し、鎖置換 DNA の合成を継続的に自己循環させます。
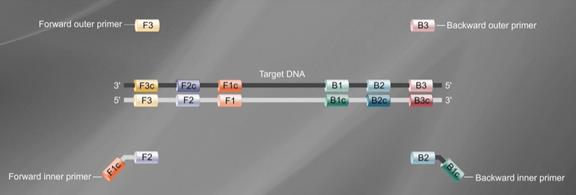
まず、ターゲット遺伝子上の 6 つの特定領域 F3、F2、F1、B1、B2、B3 を決定し、次にこれら 6 つの特定領域に基づいて 4 つのプライマーを設計します (下図を参照)。
フォワード インナー プライマー (FIP) は F1c と F2 で構成されます。
バックワードインナープライマー(BIP)はB1cとB2で構成され、中間のスペーサーとしてTTTTが使用されます。
アウタープライマー F3 および B3 は、それぞれ標的遺伝子上の F3 領域および B3 領域から構成されます。
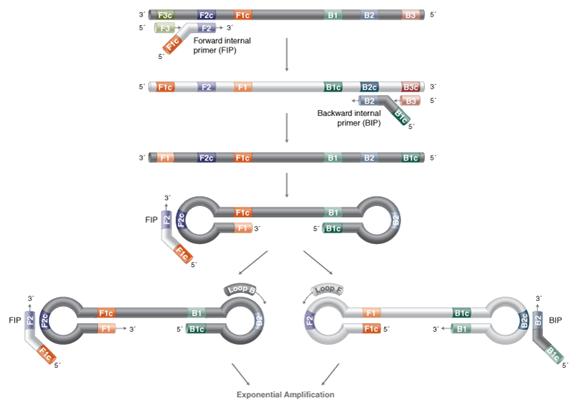
LAMP反応系ではインナープライマーの濃度がアウタープライマーの数倍になります。まずインナープライマーを鋳型鎖と結合させて相補鎖を合成し、DNA二本鎖を形成します。続いて、アウタープライマーが鋳型鎖と結合してDNA二本鎖を形成します。BstDNA ポリメラーゼの作用により、インナープライマーによって合成された相補鎖が放出されます。相補鎖は一連の反応を経て、最終的にダンベル構造を持った一本のDNA鎖を形成します。
ダンベル構造DNA一本鎖そのものを鋳型として、オープンエンドの遷移ステムループ構造DNAを連続的に形成します。内側と外側のプライマーは、遷移ステム ループ構造 DNA を誘導して鎖置換反応と伸長反応を継続的に起こし、最終的に長さの異なる複数のステム ループ構造を形成します。DNA混合物。
ループ媒介等温増幅の長所と短所
LAMP の利点:
(1) 増幅効率が高く、1時間以内に標的遺伝子の1~10コピーを効果的に増幅でき、増幅効率は通常のPCRの10~100倍です。
(2)反応時間が短く、特異性が強く、特別な装置を必要としない。
LAMP の欠点:
(1) プライマーに対する要求は特に高い。
(2) 増幅産物はクローニングや配列決定には使用できず、判定のみに使用できます。
(3) 感度が強いためエアロゾルを形成しやすく、偽陽性を引き起こし、検査結果に影響を与えます。
Sトランス変位増幅
鎖置換増幅 (SDA) は、1992 年にアメリカの学者ウォーカーによって初めて提案された、酵素反応に基づく in vitro 等温 DNA 増幅技術です。
SDA の基本システムには、制限エンドヌクレアーゼ、鎖置換活性を持つ DNA ポリメラーゼ、2 対のプライマー、dNTP、カルシウムおよびマグネシウム イオンと緩衝系が含まれます。
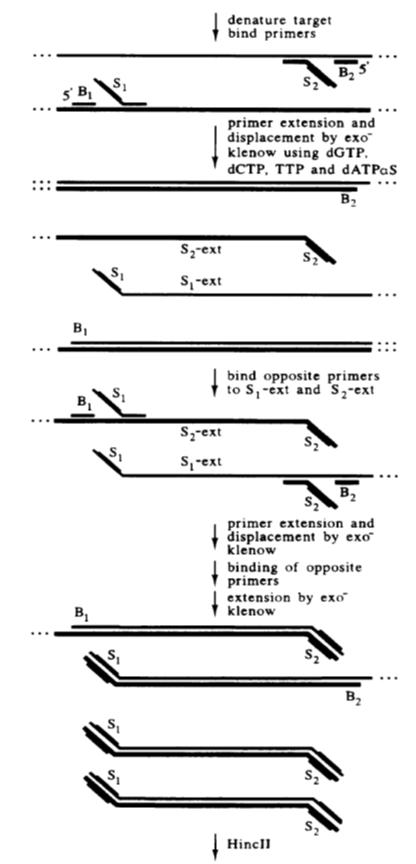
鎖置換増幅の原理は、標的 DNA の両端にある化学的に修飾された制限エンドヌクレアーゼ認識配列に基づいています。エンドヌクレアーゼは認識部位で DNA 鎖のギャップを開き、DNA ポリメラーゼはギャップの 3' 末端を拡張して次の DNA 鎖と置き換えます。
置換された一本鎖の DNA はプライマーと結合し、DNA ポリメラーゼによって二本鎖に伸長されます。このプロセスを継続的に繰り返すことで、標的配列が効率的に増幅されます。
鎖変位増幅技術のメリットとデメリット
SDA の利点:
増幅効率が高く、反応時間が短く、特異性が強いため、特別な装置を必要としません。
SDA の欠点:
生成物は均一ではなく、SDA サイクルでは必ず一本鎖と二本鎖の生成物が生成され、電気泳動で検出すると必ずテーリングが発生します。
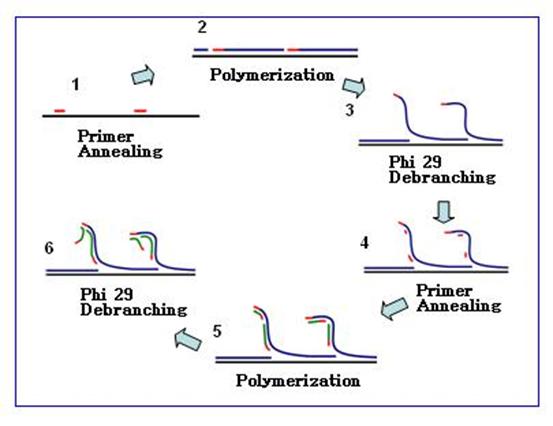
Rオーリングサークル増幅
ローリングサークル増幅(RCA)は、ローリングサークルによって病原生物からDNAをコピーする方法を利用して提案されています。これは、一定温度で一本鎖環状 DNA を鋳型として使用し、特殊な DNA ポリメラーゼ (Phi29 など) のローリングサークル DNA 合成の作用下で標的遺伝子の増幅を達成することを指します。
RCA は線形増幅と指数関数的増幅に分類できます。リニア RCA の効率は 10 に達します。5指数関数的 RCA の効率は 10 倍に達する可能性があります。9回。
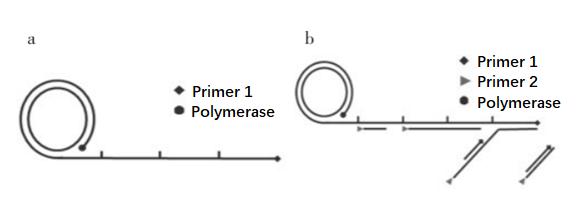
簡単に区別すると、下図に示すように、リニア増幅 a はプライマーを 1 つだけ使用し、指数関数的増幅 b はプライマーを 2 つ使用します。
リニア RCA はシングルプライマー RCA とも呼ばれます。プライマーは環状 DNA に結合し、DNA ポリメラーゼの作用によって伸長します。この生成物は、単一ループの長さの数千倍の多数の反復配列を含む直鎖状の一本鎖です。
リニア RCA の製品は常に開始プライマーに接続されているため、信号の固定が容易であることが大きな利点です。
指数関数的 RCA、ハイパー分岐増幅 HRCA (ハイパー分岐 RCA) とも呼ばれます。指数関数的 RCA では、1 つのプライマーが RCA 産物を増幅し、2 番目のプライマーが RCA 産物とハイブリダイズして伸長し、置換が既に RCA 産物に結合しています。下流のプライマーが鎖を伸長し、伸長と置換を繰り返して樹状 RCA 増幅産物を生成します。
ローリングサークル核酸増幅の長所と短所
RCA の利点:
高感度、良好な特異性、そして簡単な操作。
RCA の欠点:
信号検出中のバックグラウンドの問題。RCA 反応中、循環していない南京錠プローブと結合していないプローブの鋳型 DNA または RNA がバックグラウンドシグナルを生成する可能性があります。
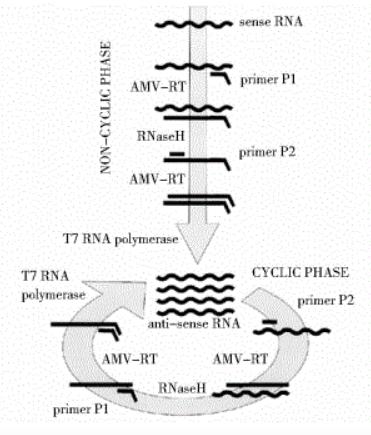
N核酸配列に基づく増幅
核酸配列ベースの増幅 (NASBA) は、PCR に基づいて開発された新しい技術です。これは、T7 プロモーター配列を備えた一対のプライマーによって誘導される、連続的な等温核酸増幅です。同技術は、従来のPCR法と比べて約1000倍となる約2時間で鋳型RNAを約109倍に増幅することができ、特別な装置を必要としない。
この技術は病気が出現してすぐに迅速な診断に使用されており、現在多くの企業がこの方法を RNA 検出キットに使用しています。
RNA 増幅には逆転写 PCR 技術を使用することもできますが、NASBA には独自の利点があります。比較的一定の温度条件下で実行でき、従来の PCR 技術よりも安定性と精度が高いという点です。
反応は摂氏 41 度で行われ、完了するには AMV (鳥骨髄芽球症ウイルス) 逆転写酵素、RNase H、T7 RNA ポリメラーゼ、および 1 対のプライマーが必要です。
プロセスには主に次のものが含まれます。
フォワードプライマーには、T7 プロモーターの相補配列が含まれています。反応中、フォワードプライマーは RNA 鎖に結合し、AMV 酵素によって触媒されて DNA-RNA 二本鎖を形成します。
RNase H はハイブリッド二本鎖の RNA を消化し、一本鎖 DNA を保持します。
リバースプライマーと AMV 酵素の作用により、T7 プロモーター配列を含む DNA 二本鎖が形成されます。
T7 RNA ポリメラーゼの作用により、転写プロセスが完了し、大量の標的 RNA が生成されます。
NASBA の利点:
(1) プライマーにはT7プロモーター配列が存在しますが、外来二本鎖DNAはT7プロモーター配列を持たず増幅できないため、特異性と感度が高い技術です。
(2) NASBA は逆転写プロセスを増幅反応に直接組み込むため、反応時間が短縮されます。
NASBAのデメリット:
(1) 反応成分がより複雑になる。
(2)3種類の酵素が必要となり、反応コストが高くなる。
投稿時間: 2021 年 8 月 6 日