PCR試薬の初期段階でプライマーやプローブの性能を検証し、最適な反応条件を決定することは、正式な実験をスムーズに進めるための必須条件です。
では、初期段階でプライマープローブを確認するにはどうすればよいでしょうか?
主な指標は、ベースライン、増幅曲線、ct値、増幅効率、低濃度サンプル検出、CVなどです。
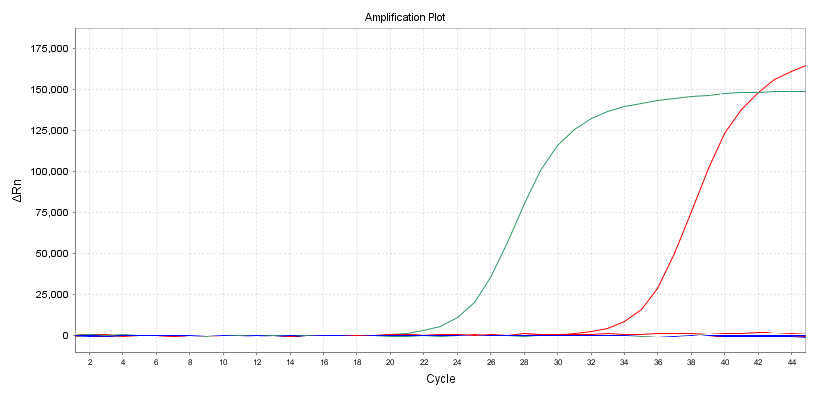
増幅曲線
もう 1 つの直感的な指標は、増幅曲線の形状です。二次増幅やその他の異常な増幅曲線を避けるために、S 字型の曲線を持つことが最善です。
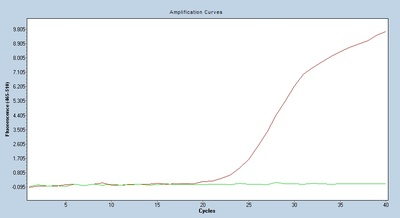
Ct値
ベースラインから指数関数的増加までの変曲点に対応するサイクル数が Ct 値です。
同じサンプルでもプライマープローブが異なれば増幅曲線も異なり、対応する Ct 値は増幅効率と干渉度の影響を受けます。理論的には、選択するプライマー プローブの Ct 値が小さいほど優れています。
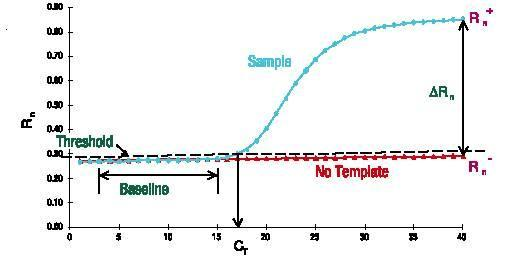
増幅効率
PCR 増幅効率を評価するための最も信頼性が高く安定した方法の 1 つは標準曲線であり、これも研究者によって広く認識されています。この方法では、ターゲット テンプレートの相対数を制御するために一連のサンプルを作成します。これらのサンプルは通常、濃縮原液の段階希釈によって作成され、最も一般的に使用されるのは 10 倍希釈です。一連の希釈サンプルを使用し、標準 qPCR プログラムを使用して増幅して Cq 値を取得し、最後に各サンプルの濃度と対応する Cq 値に従って標準曲線を描き、直線方程式 Cq= -klgX0+b および増幅効率 E=10(-1 /k)-1 を取得します。定量分析に qPCR を使用する場合、増幅効率は 90% ~ 110% の範囲 (3.6>k>3.1) である必要があります。
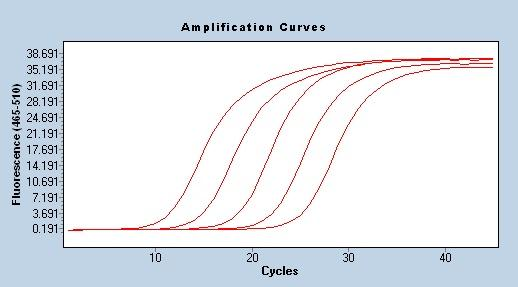
低濃度サンプルの検出
サンプル濃度が低い場合、プライマープローブごとに検出率が異なります。複製する低濃度サンプルを 20 個選択し、検出率が最も高いプライマー プローブ システムが最適です。
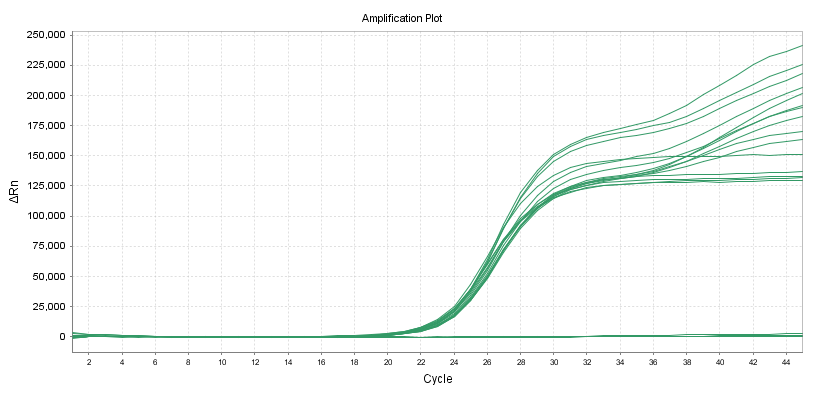
変動係数 (CV)
核酸増幅検出用試薬のラインスタンダードに応じて、異なるプライマープローブを使用して10個の重複サンプルを検出できます。
定量試薬:
正確さ
1 バッチ内の精度は、試験濃度の対数値の変動係数 (CV、%) が 5% 以下を満たす必要があります。サンプル濃度が低い場合、検出濃度の対数の変動係数 (CV、%) が 10% 以下になります。
定性試薬:
正確さ
1 つのバッチ内の精度は次の条件を満たす必要があります。
(1) Ct値の変動係数(CV,%)≦5%
同じサンプルを並行して 10 回テストし、テスト結果は一貫している必要があります。
投稿時間: 2021 年 9 月 18 日